根据化学反应方程式的计算 知识点题库
下列四个图像分别表示对应的四种操作过程,其中表示正确的图像是 ( ) 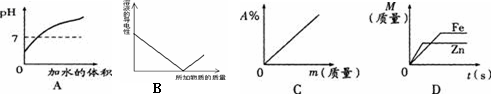
A . 向pH=1的酸溶液中不断加水
B . 在稀硫酸中加入氢氧化钡溶液,溶液的导电性变化的情况
C . 某温度下,向一定量的水中持续加入食盐并不断搅拌 (m:加入食盐的质量,A%:溶质质量分数)
D . 足量的的锌、铁与等质量、等质量分数稀硫酸反应,产生氢气的质量M与反应时间t的关系图
一定条件下用NH3捕捉CO2的反应为3NH3+3CO2=C3H3N3O3+3H2O,生成的三聚氰酸(C3H3N3O3 , 相对分子质量为129)是重要的化工产品.请回答下列问题:
-
(1) 三聚氰酸中C、H、N、O四种元素的质量之比为 .
-
(2) 每生产25.8kg三聚氰酸,可以捕捉CO2的质量为 .
-
(3) Na2CO3溶液同样能用于“捕捉”CO2 , 反应为Na2CO3+H2O+CO2=2□,□中物质的化学式为 .
现有在敞口容器中放置的氢氧化钠固体,分析得知含水6.62%、碳酸钠2.38%、氢氧化钠91%.将此样品1g放入烧杯中,然后向其中加入46克溶质质量分数为3.65%的稀盐酸,过量的稀盐酸用溶质质量分数为4.43%的氢氧化钠溶液恰好中和,用去氢氧化钠的溶液20.5g.蒸干中和后的溶液,可得到固体的质量为 g.
为了测定实验室中高锰酸钾样品的纯度(杂质不参加反应),取16g该样品加热,完全反应后,得到1.6g氧气,求样品中高锰酸钾的质量。
将91.6g氢氧化钾溶液与一定质量的氯化镁溶液混合,恰好完全反应,过滤后,得到11.6g沉淀和280g滤液,求氯化镁溶液的溶质质量分数.
将5%的NaOH溶液逐滴加入到20克稀盐酸中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示,请计算:
-
(1) 当恰好完全反应时,消耗NaOH溶液的质量为克;
-
(2) 请计算稀盐酸中溶质的质量分数(写出计算过程).
取一定质量的CaCO3高温加热一段时间后,冷却,测得剩余固体的质量为10.0 g,剩余固体中钙元素质量分数为50.0%。(已知CaCO3=CaO+CO2↑)下列判断正确的是( )
A . 生成2.0 gCO2气体
B . 原来CaCO3为12.5 g
C . 生成了5.6 gCaO
D . 剩余CaCO3为3.0 g
发射通信卫星的火箭用化学反应2N2H4+N2O4  3X+4H2O为动力来源.
3X+4H2O为动力来源.
 3X+4H2O为动力来源.
3X+4H2O为动力来源.
-
(1) 上述化学反应中X的化学式是;
-
(2) 请计算320g N2H4完全燃烧时消耗N2O4的质量.
用煤直接做燃料如果不进行处理,会因煤中的硫生成SO2气体造成大气污染。
-
(1) 现有南方产的一种煤含硫8%。某火力发电厂燃烧100t这种煤,假设燃烧时煤中的硫全部转化为SO2 , 则产生SO2的质量是多少?
-
(2) 如在煤中混入粉末状的石灰石,则燃烧产生的SO2会与CaCO3反应生成CaSO3进入炉渣而减少大气污染。取50g此炉渣(含24%CaSO3)逐滴加入20%的盐酸,请在下图坐标中画出相应的曲线图(纵坐标为盐的质量,请设定具体物质;并标出曲线中必要的数据)。

【已知】①设炉渣已不含石灰石,炉渣其它成分不与盐酸反应;②CaSO3和盐酸反应类似于CaCO3
-
(3) 向燃烧后的烟气喷洒石灰浆也可吸收SO2生成CaSO3。现用一万元分别购买两种原料来除去SO2 , 相关数据如下表:
方法
物质
相对分子质量
纯度
价格(元/t)
除SO2的量(t)
A
石灰石
100
90%
200
14.4
B
熟石灰
74
94%
500
14.6
方法B比方法A除SO2的量略大,而且工业上多数采用方法B。其原因分别是:。
某同学为定量研究氢氧化钠溶液与盐酸反应,做了如下实验:取40g氢氧化钠溶液,加入到50g溶质质量分数为7.3%的稀盐酸中,恰好完全反应。计算:
-
(1) 氢氧化钠溶液中溶质的质量分数是。
-
(2) 反应后所得溶液中溶质的质量分数。(写出计算过程)
某厂生产的纯碱中含有少量氯化钠,为测定该样品中碳酸钠的质量分数,现准确称取12g该样品于烧杯中,并逐滴加入稀盐酸至不再产生气泡,共消耗稀盐酸73g,此时称得烧杯溶液的总质量为80.6g.
请计算:
-
(1) 产生二氧化碳气体的质量是多少?
-
(2) 样品中碳酸钠的质量分数.(结果精确到0.1%)
现有18.6gNaOH、Na2CO3固体,测得其中钠元素与碳元素的质量比为23∶3.在室温下,将该混合物与100g稀硫酸混合,恰好完全反应,所得不饱溶液质量114.2g,则原固体中含有钠元素的质量为( )
A . 3.3g
B . 4.6g
C . 9.2g
D . 13.8g
26g黄铜(Cu-Zn合金)与100g稀硫酸在烧杯中恰好完全反应,反应后测得烧杯中剩余物的总质量为125.8克。求:
-
(1) 黄铜中铜的质量分数;
-
(2) 反应后所得溶液中溶质质量分数。(计算结果精确到0.1%)
某同学取硫酸钠和硫酸镁固体混合物26.2g,向其中加入219.6g水,使其完全溶解配制成溶液。将200g一定溶质质量分数的氢氧化钠溶液平均分成5等份,依次加入到上述溶液中,生成沉淀的质量与加入氢氧化钠溶液的质量关系如下表:
|
氢氧化钠溶液加入量/g |
第一次加入40 |
第二次加入40 |
第三次加入40 |
第四次加入40 |
第五次加入40 |
|
产生沉淀质量/g |
1.45 |
2.9 |
m |
5.8 |
5.8 |
计算:
-
(1) m的值为。
-
(2) 固体混合物中硫酸镁的质量。
-
(3) 恰好完全反应时,所得不饱和溶液中溶质的质量分数。
某同学将20g铁和铜的混合物放入烧杯中,加入一定质量分数的稀硫酸100g,恰好完全反应后,测得反应后烧杯中剩余物的质量为119.6g。请计算:
-
(1) 恰好完全反应时生成氢气的质量是g。
-
(2) 原20g混合物中铜的质量分数(写出计算过程)。
某化学兴趣小组的同学取氢氧化钾和碳酸钾的混合溶液50g装入烧杯中,每次滴加一定溶质质量分数的稀盐酸50g充分反应(反应化学方程式为:① 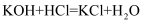 ②
② 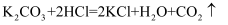 )测得部分数据及图像如下:
)测得部分数据及图像如下:
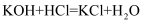 ②
② 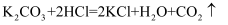 )测得部分数据及图像如下:
)测得部分数据及图像如下: | 次数 | 1 | 2 | 3 | 4 | 5 |
| 加入稀盐酸的质量/g | 50 | 50 | 50 | 50 | 50 |
| 烧杯中物质的质量/g | 100 | 150 | 197.8 | 245.6 | 295.6 |
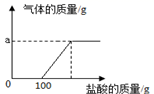
请根据有关信息计算:
-
(1) K2CO3中碳元素与氧元素质量比为:;(写最简比)
-
(2) 稀盐酸与混合溶液恰好完全反应时生成二氧化碳质量克;
-
(3) 所加入稀盐酸的溶质质量分数为多少?(写出计算过程)
镁与盐酸(HCl)反应生成氢气和氯化镁。实验室欲制取2g的氢气,需要金属镁的质量是多少?(提示:Mg + 2HCl=MgCl2
+ H2↑)
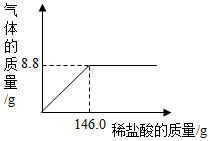
我县地处喀斯特地区,石灰石资源丰富。某化学小组为测定石灰石样品(杂质不溶于水也不与水反应)中碳酸钙的质量分数,他们取25.0g样品粉碎放入烧杯中,加入足量的稀盐酸,所加稀盐酸的质量与生成气体的质量关系如图所示。请计算
-
(1) CaCO3中钙、碳、氧三种元素的质量比为。(写最简比)
-
(2) 完全反应生成气体的质量是g。
-
(3) 样品中碳酸钙的质量分数。(写出计算过程)
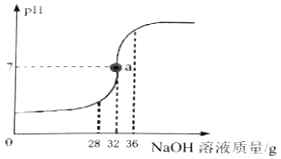
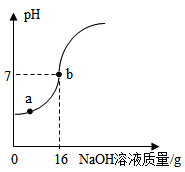
实验室欲测定一瓶标签破损的稀盐酸的溶质质量分数,现取10g稀盐酸样品,将5%的氢氧化钠溶液逐滴加入到样品中,边加边搅拌,随着氢氧化钠溶液的加入,溶液pH的变化情况如图所示。请回答:
-
(1) a点溶液中含有的离子是(填写化学符号)。
-
(2) pH=7时,消耗氢氧化钠的质量为g。
-
(3) 计算稀盐酸的溶质质量分数。(计算结果精确至0.1%)。
学习小组对贝壳(主要成分为CaCO3)与稀盐酸的反应进行了研究。
-
(1) Ⅰ、研究贝壳的状态对反应速率的影响
取等纯度、等质量的块状和粉末状贝壳,分别加入足量等浓度的稀盐酸,实验过程中生成气体的体积随时间变化的情况如图所示(贝壳中的杂质不与稀盐酸反应)。

结合实验分析图中曲线,可得出结论:。
-
(2) Ⅱ、测定贝壳中碳酸钙的质量分数
小组取10g贝壳,按照如图所示过程进行实验。实验过程中测得不同时刻装置和药品总质量随时间变化的数据见下表。请计算:
时刻
t0
t1
t2
t3
装置和药品总质量/g
240.00
237.00
236.48
236.48
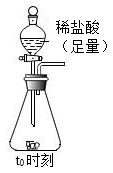
实验中共产生二氧化碳g。
-
(3) 该贝壳中碳酸钙的质量分数(写出计算过程)。
最近更新



