海洋中的资源 知识点题库
资源是宝贵的财富,下列有关资源的说法错误的是( )
A . 化石燃料是不可再生能源,其中天然气是比较清洁的燃料
B . 地壳中含量最高的金属元素是铝,以化合物的形式存在
C . 空气是一种宝贵的资源,其中氮气和氧气的体积比约为4:1
D . 地球上可利用的淡水资源有限,海水资源丰富,海水中含有80多种金属元素
下列有关资源、能源的叙述错误的是( )
A . 空气中含量最多的单质是氮气
B . 按目前测定,海水中含量最多的元素是氧元素
C . 煤、石油、沼气、风能等都是可再生能源
D . 防止金属腐蚀是保护金属资源的有效途径
下列归纳和总结完全正确的一组是( )
A化学与生活 | B化学与安全 |
①用洗涤剂去除油污 ②用镶有金刚石的玻璃刀裁玻璃 ③用生石灰作食品干燥剂 | ①炒菜锅着火可以用锅盖盖火 ②在室内一盆水能防止煤气中毒 ③夜间发现液化气泄漏开灯寻找泄漏源 |
C化学与资源 | D化学与发现 |
①防止金属腐蚀是保护金属资源的途径之一 ②煤、石油、天然气是可在再生能源 ③海洋中蕴藏着丰富的化学资源 | ①波义耳发现了质量守恒定律 ②门捷列夫发现元素周期律编制元素周期表 ③拉瓦锡发现空气的组成 |
A . A
B . B
C . C
D . D
下列关于资源、能源的叙述正确的是( )
A . 自然资源都是“取之不尽,用之不竭”的
B . 地壳中含有最多的金属元素是铝,人类每年在自然界中提取最多的金属是铁
C . 金属资源主要存在于地壳中,海水中不可能含有金属资源
D . 可燃冰主要含有甲烷水合物,还含有少量的一氧化碳等气体,它将成为未来新能源
下列关于资源的叙述错误的是( )
A . 地球上的金属资源广泛地存在地壳和浩瀚的海洋中
B . 海洋中含量最多的物质是氯化钠
C . 目前人们已制得纯金属90余种,其中铁在春秋战国时期就在我国开始生产和使用
D . 我国稀土含量居世界第一,但我国生产的主要是低端稀土产品
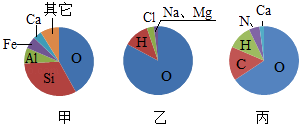
根据如图甲、乙、丙三幅元素含量示意图,试推测元素分布领域(填图下序号):分布在人体中的是;分布在海水中的是;分布在地壳中的是.
海洋是巨大的资源宝库,从化学的视角看:
-
(1) 元素资源:海水中含量最高的金属元素是(填元素符号);从物质在水中溶解的规律和水天然循环的角度看,该元素含量最高的原因是.
-
(2) 淡水资源:淡化海水可以用(填字母代号);
A.吸附法 B.蒸馏法 C.过滤法 D.电解法
该过程是(填“化学变化”或“物理变化”).
-
(3) 矿产资源:海底蕴藏着大量的“可燃冰”(含甲烷),甲烷燃烧的化学反应方程式为.
-
(4) 你还知道海洋中有哪些资源?(写一种)
西沙群岛及附近海域时我国神圣不可侵犯的领域,海底蕴含着大量的可燃冰,可燃冰的主要成分是甲烷水合物,请你回答下列问题:
-
(1) 海水属于(填“纯净物”或“混合物”),海水中含有大量氯化钠,氯化钠是由(填离子符号)和Cl﹣构成。
-
(2) 可燃冰属于(填“可再生”或“不可再生”)能源;
-
(3) 甲烷燃烧的化学方程式为;
-
(4) 甲烷是重要的化工原料,一定条件下与CO2反应生成CO和H2 , CO和H2又可化合成液体燃料CH3OH,则参加反应的CO和H2的分子数之比为。
下列关于能源与资源的说法错误的是()
A . 海洋中含有80多种元素
B . 可利用淡水资源只约占全球水储量的2.53%
C . 空气是重要的自然资源,其中氮气的体积分数约为78%
D . 地壳中含量最多的金属元素是铝
下列说法错误的是( )
A . 粗盐经过溶解过滤蒸发结晶后,得到的是纯净氯化钠
B . 海水“晒盐”所得的“苦卤”是食盐的饱和溶液
C . 海底“可燃冰”的主要成分为甲烷
D . 工业上常用“多级闪急蒸馏法”淡化海水
下列关于资源、能源、环保方面的叙述错误的是( )
A . 海水中含有80多种元素,是巨大的资源宝库
B . 世界上已有50%以上的铁和90%以上的金得到了回收利用
C . 地壳中含量最多的元素是氧元素,它的质量分数接近于50%
D . 世界每年因腐蚀而报废的金属设备和材料相当于年产量的50%-60%
领海主权不容侵犯,南海是我国的固有领海,蕴藏着丰富的海洋资源。
-
(1) 南海不仅蕴含着大量的煤、石油、天然气等常规能源,还蕴藏着大量的可燃冰。可燃冰被科学家誉为“未来能源”,可燃冰属于(填纯净物或混合物);南海还有丰富的鱼业资源,海鱼的主要营养素是。
-
(2) 南海某岛对海水进行了如图所示的综合利用。

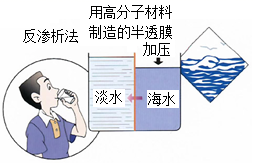
①反渗析法淡化海发生的是变化(填物理或化学)。
②将高盐度浓缩海水进行可以分离得到粗盐。
-
(3) 用苦卤(含有氯化镁)制取金属镁的主要流程图如下:

写出步骤Ⅰ反应的化学方程式:。根据电解水的原理写出步骤Ⅲ的化学方程式:。
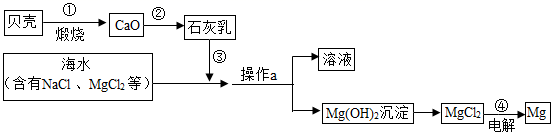
利用海水制备镁的流程如图所示:
-
(1) 操作a的名称是,需要的玻璃仪器有。
-
(2) 写出第②、③步反应的化学方程式:;。
-
(3) 在③中加入石灰乳过量的目的是,可加入试剂观察到证明所加石灰乳已经过量。
下图是分离与提纯海水的流程:
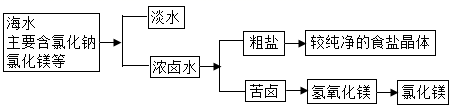
下列有关认识错误的是( )
A . 通常在苦卤中加入熟石灰制取氢氧化镁
B . 粗盐提纯为较纯净的食盐晶体的操作为溶解、过滤、蒸发
C . 常用于淡化海水的方法有蒸馏法、过滤法等
D . 海水中的食盐用途广泛,例如侯德榜利用食盐为原料制得了纯碱
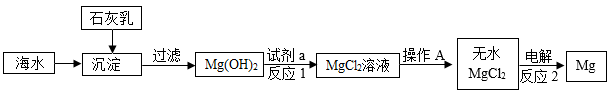
金属镁被誉为“国防金属”,目前世界上60%的镁是从海水提取的。某兴趣小组在实验室模拟海水提镁的主要流程如下:
-
(1) 过滤后,滤液仍浑浊的可能原因是。(写出一点即可)
-
(2) 试剂a是(填化学式),并写出反应1的化学方程式。
-
(3) 操作A的名称:,反应2属于(填基本反应类型)。
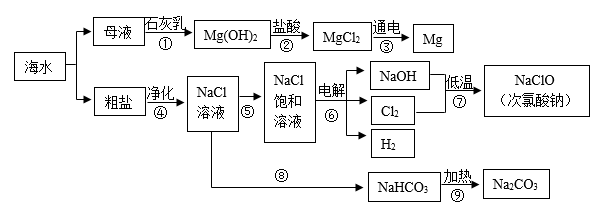
2021年6月8日是第13个“世界海洋日”,烟台有漫长的海岸线,蕴藏着丰富的海洋资源。某兴趣小组设计的综合利用海水的部分流程图如下、据图回答:
-
(1) 海水制镁。步骤①②③是利用母液制镁的流程,该流程中发生中和反应的化学方程式是。步骤①中制取氢氧化镁选择向母液中加入石灰乳,而不是向海水中直接加入石灰乳,原因是。
-
(2) 海水晒盐。通常采用(填“降温”或“蒸发”)结晶的方法使海水中的氯化钠析出。通过步骤④除去粗盐溶液中含有的MgCl2、Na2SO4、CaCl2等可溶性杂质,需要依次加入过量的BaCl2溶液、过量的Na2CO3溶液、过量的NaOH溶液,然后过滤,在滤液中加入适量的稀盐酸。其中加入过量的Na2CO3溶液的目的是。
-
(3) 海水制碱。步骤⑧⑨是氨碱法制纯碱的流程,步骤⑧中需要向NaCl饱和溶液中先后加入的两种物质是(写化学式)。步聚⑨中发生反应的化学方程式是。
-
(4) 步骤⑥是电解NaCl饱和溶液制取烧碱,该反应中的反应物是。
-
(5) 步骤⑦用烧碱低温制取次氯酸钠的反应原理为:
 。则X的化学式是。
。则X的化学式是。
NaCl是重要的资源,其应用与生产如图所示。下列说法错误的是( )
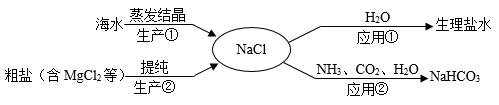
A . 应用①配制溶质质量分数为0.9%的生理盐水
B . 生产①中将海水经过蒸发结晶可获得粗盐
C . 应用②制得的NaHCO3在生活中俗称小苏打
D . 生产②中粗盐提纯时,可用过量KOH溶液除去MgCl2
一种工业制备无水氯化镁的工艺流程如图所示。下列说法正确的是( )
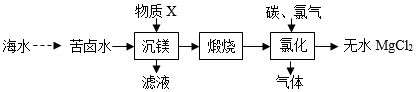
A . 苦卤水含大量MgCl2 , 物质X可选用CaO
B . MgCl2溶液中含有FeCl3可以加入NaOH除去
C . “氯化”过程中发生的反应为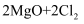

 D . “煅烧”所得产物中加稀盐酸,将所得溶液加热蒸干可得MgCl2﹒6H2O
D . “煅烧”所得产物中加稀盐酸,将所得溶液加热蒸干可得MgCl2﹒6H2O

 D . “煅烧”所得产物中加稀盐酸,将所得溶液加热蒸干可得MgCl2﹒6H2O
D . “煅烧”所得产物中加稀盐酸,将所得溶液加热蒸干可得MgCl2﹒6H2O
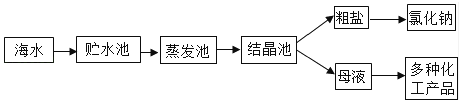
利用海水提取粗盐的过程如下图所示,回答有关问题:
-
(1) 一定质量的海水,通过贮水池引入到蒸发池中,在没有引入结晶池之前的蒸发过程中,蒸发池中氯化钠的质量会(填“增大”、“不变”或“减小”),析出晶体后得到的母液是氯化钠的(填“饱和”或“不饱和”)。
-
(2) 粗盐中含有的难溶性杂质,在实验室里可以通过溶解、过滤、蒸发等操作将其去除,这些操作中都会用到玻璃棒,其中在过滤操作中玻璃棒的作用是(填“引流”或“加快溶解”)。
-
(3) 用氯化钠固体配制100g质量分数为6%的氯化钠溶液。
①配制时,涉及以下实验步骤:A.称量及量取B.计算C.溶解D.装瓶贴标签。其正确的实验步骤顺序是。(填字母)
②将已配好的100g质量分数为6%的氯化钠溶液变成质量分数为16%的氯化钠溶液,需要再加NaCl的质量是g(计算结果精确到0.1)
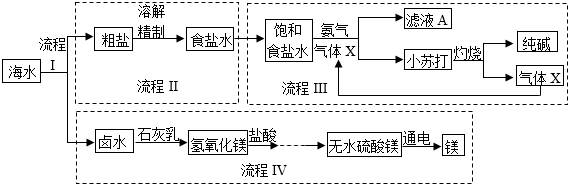
海洋是巨大的资源宝库。“筑梦”学习小组模拟化工厂生产流程,利用海水制取纯碱和金属镁,设计方案如下图所示。请回答下列问题。
-
(1) 流程I为海水“晒盐”。由海水获得粗盐的结晶方法是。
-
(2) 流程Ⅱ为粗盐精制。粗盐中通常含有泥沙等难溶性杂质和Ca2+、Mg2+、
 等可溶性杂质离子。为除去上述可溶性杂质离子,将粗盐溶解并依次加入下列试剂:过量氢氧化钠溶液→过量氯化钡溶液→a→适量稀盐酸。
等可溶性杂质离子。为除去上述可溶性杂质离子,将粗盐溶解并依次加入下列试剂:过量氢氧化钠溶液→过量氯化钡溶液→a→适量稀盐酸。①上述除杂过程中,a是。
②有同学认为,用一种试剂代替氢氧化钠和氯化钡两种试剂也能达成实验目的,该试剂是。
-
(3) 流程Ⅲ为海水“制碱”。滤液A中碳酸氢钠是否饱和?(填“是”或“否”):写出流程I生成小苏打的化学方程式。
最近更新



