酸碱盐的溶解性 知识点
碱只有五种可溶:氢氧化钾、氢氧化钠、氨水、氢氧化钡、氢氧化钙
盐:氯化物只氯化银不溶,其它可溶
硫酸盐只硫酸钡不溶,其它可溶
碳酸钠只碳酸钠、碳酸钾、碳酸铵可溶,其它都不溶
硝酸盐全部可溶
酸碱盐的溶解性 知识点题库
Cl﹣ | SO42﹣ | CO32﹣ | |
K+ | ① | 溶 | 溶 |
Na+ | 溶 | 溶 | 溶 |
Ba2+ | 溶 | ② | 不 |
-
(1) 表中“溶”表示该位置的物质可溶于水,“不”表示;
-
(2) 表中位置①代表的物质的化学式为;
-
(3) 写出生成物中含有位置②代表的物质的一个化学反应方程式:.
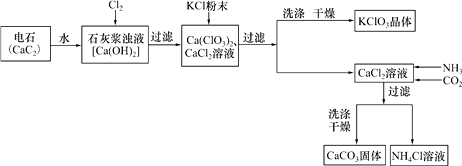
-
(1) 请将电石与水反应的化学方程式补充完整:
CaC2+2H2O=Ca(OH)2+↑;
-
(2) 有关物质常温下的溶解度如下表:
物质
Ca(ClO3)2
CaCl2
KClO3
KCl
溶解度/g
209.0
74.5
7.3
34.2
上述流程中加入了KCl粉末,KCl与(填化学式)发生了复分解反应得到KClO3晶体,该过程得到KClO3晶体的原因是。
 向氢氧化钠溶液中不断加水,溶液pH与加入水的质量的关系
B .
向氢氧化钠溶液中不断加水,溶液pH与加入水的质量的关系
B .  向盛有氧化铜的烧杯中加入稀盐酸至过量,生成氯化铜质量与加入稀盐酸质量的关系
C .
向盛有氧化铜的烧杯中加入稀盐酸至过量,生成氯化铜质量与加入稀盐酸质量的关系
C . 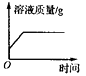 一定量的稀硫酸与锌粒反应,溶液的质量与反应时间的关系
D .
一定量的稀硫酸与锌粒反应,溶液的质量与反应时间的关系
D .  向氯化铜和硝酸铜的混合溶液中滴加氢氧化钠溶液,生成沉淀与加入氢氧化钠溶液的质量关系
向氯化铜和硝酸铜的混合溶液中滴加氢氧化钠溶液,生成沉淀与加入氢氧化钠溶液的质量关系
步骤I:取少量固体于烧杯中,加水,搅拌,固体全部溶解,得到无色溶液A。
步骤Ⅱ:取少量溶液A于试管中,滴加过量MgCl2溶液,有白色沉淀产生;再加入过量稀盐酸,沉淀消失,有气泡产生。
-
(1) 步骤Ⅱ中产生的气泡是(填化学式)
-
(2) 根据上述实验推断该混合物的成分,肯定含有的是,可能含有的是。
-
(3) 设计实验进一步确定混合物组成,依次用到的试剂是。
 CuSO4
CuSO4  Cu(OH)2
B . S
Cu(OH)2
B . S  SO2
SO2 H2SO4
C . Fe
H2SO4
C . Fe  FeCl3
FeCl3  AgCl
D . C
AgCl
D . C  CO2
CO2  CaCO3
CaCO3

-
(1) 化学式:B ,F 。
-
(2) 自然界中,甲和D反应产生一种供呼吸的气体,该反应名称为。
-
(3) 反应①、②的化学方程式:① ;②。
-
(4) 由反应②可知,在农业上施用G时应注意。

-
(1) G的化学式是。
-
(2) 写出反应①的化学方程式为。
-
(3) 反应③属于基本反应类型中的。
-
(4) 反应②在生活中的应用是。
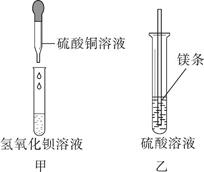
(查阅资料)硫酸钡不溶于水也不溶于酸。
(实验分析)甲实验中发生反应的化学方程式为。
(提出问题和猜想)烧杯中白色沉淀的成分是什么呢?
猜想:BaSO4
猜想Ⅱ:Mg(OH)2和BaSO4;
猜想Ⅲ:Cu(OH)2和BaSO4;
同学们经过讨论认为猜想Ⅲ错误,其理由是。
(实验方案)
| 实验操作 | 实验现象与结论 |
| 过滤洗涤白色沉淀然后向白色沉淀中加入 盐酸至过量 | ,猜想Ⅱ成立; |
(拓展与思考)要证明乙试管中硫酸溶液是否有剩余可采用的不同类别的试剂有①,②。(不能选用题中已用试剂)
-
(1) 物质性质反映其组成和结构。从宏观进入微观,探索物质变化规律。
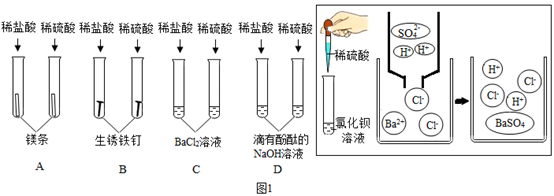
①不同酸具有相似的化学性质。图1中能体现酸的通性的是(填序号);稀盐酸不能与氯化钡溶液反应,而稀硫酸则能与之反应生成白色沉淀,据图从微粒的角度分析写出该反应的实质是;
-
(2) 物质组成和结构决定其性质。从微观进入宏观,探索物质变化规律。
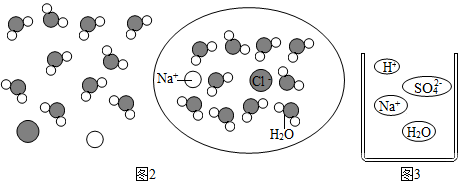
①图2圆圈中表示这杯氯化钠溶液的构成,则该氯化钠溶液中溶质和溶剂的质量比是;
②通过分析组成和结构,可以预测物质的某些性质。根据图3硫酸氢钠溶液的微观图示,分析推
 ,的性质,其中合理的是。
,的性质,其中合理的是。A、其水溶液能与氢氧化铜发生反应
B、其水溶液能使紫色石蕊试液变红
C、其水溶液能与金属锌反应生成氢气
D、其水溶液能与硝酸钡溶液反应生成白色沉淀
|
阴离子/阳离子 |
氢氧根离子 |
硝酸根离子 |
氯离子 |
硫酸根离子 |
碳酸根离子 |
|
H+ |
溶、挥 |
溶、挥 |
溶 |
溶、挥 |
|
|
Na+ |
溶 |
溶 |
溶 |
溶 |
溶 |
|
Ba2+ |
溶 |
溶 |
溶 |
不 |
不 |
|
Cu2+ |
不 |
溶 |
溶 |
溶 |
— |
请依据上表,按要求回答下列问题:
-
(1) 写出氢氧根离子的符号.
-
(2) 写出一种不溶性碱的化学式,写出一种可溶性盐的化学式。
-
(3) 氯化钙溶液与硝酸钠溶液(填“能”或“不能”)发生反应,原因是。
-
(4) 碱和盐反应时,反应物一般都须是可溶的.请写出一个碱和盐反应的化学方程式:。
-
(5) NaOH和Ca(OH)2是两种可溶性碱,其溶液均为无色.请写出一种能鉴别这两种物质的试剂名称.



