粗盐提纯 知识点
除粗盐中可溶性杂质:要先加入试剂除去杂质,将可溶性杂质转化成沉淀,再过滤除去,最后蒸发,注意加入试剂均过量,要保证在除杂过程中不能引入新杂质,所以有些药品加入需按先后顺序。
粗盐提纯 知识点题库
化学与生活、生产密切相关,请用所学知识回答问题:
(1)如图是超市销售的一种食盐标签的部分文字说明,请按要求回答:
①从成分上看,食盐中除含有NaCl外还有KIO3 , KIO3的作用是 ;
②家庭生活中,食盐除了可以调味,还可用于 .
(2)炒菜时油锅中的油不慎着火,可用锅盖盖灭或放入较多的蔬菜,其目的是 .

a.除去石灰水中的碳酸钙.
b.除去硝酸钾固体中少量的氯化钠.
c.除去硫酸锌溶液中的水.
d.提纯含泥沙的食盐.
 B .
B .  C .
C .  D .
D . 
-
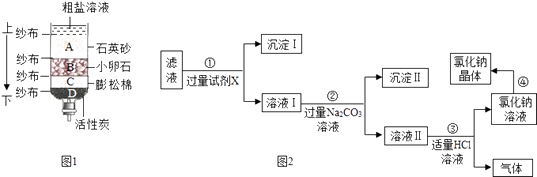
(1) 请按由上到下的顺序重新排列(填字母).
-
(2) 调整后净化的盐水仍含可溶性杂质,他设计了下面的除杂流程:
如图2中步骤①②都需要进行操作,步骤④需要进行操作.
-
(3) 已知试剂X是碱溶液,则沉淀I为(写化学式),下列碱溶液不符合要求的是(填序号).
A.氢氧化钠溶液 B.氢氧化钡溶液 C.氢氧化钾溶液 D.氢氧化钙溶液
-
(4) 步骤②除去氯化钙的反应方程式是;步骤③中发生中和反应的化学方程式是.
| 操作 | 目的 |
A | 将过滤后的澄清滤液倒入蒸发皿中加热蒸干 | 除去粗盐中的难溶性杂质 |
B | 取一小块乒乓球碎片和滤纸碎片,分别用坩埚钳夹住,放在酒精灯火焰上加热 | 证明燃烧的条件之一是要有氧气 |
C | 将红热的木炭迅速伸入盛有氧气的集气瓶底部 | 观察木炭在氧气里燃烧的现象 |
D | 在盛有水的小烧杯中加入少量品红 | 证明品红在静置的水中会扩散 |
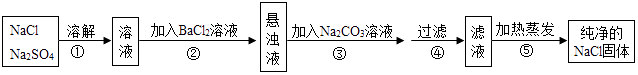
回答下列问题.
-
(1) 操作②能否用硝酸钡溶液?说明理由.
-
(2) 进行操作②后,如何判断硫酸钠已除尽,方法是.
-
(3) 操作③的目的是.

-
(1) 操作①中必须用到的一种仪器是 (填序号)。A . 研钵 B . 量筒 C . 烧杯 D . 试管
-
(2) 操作③的名称是,操作④中用到玻璃棒,作用为。
-
(3) 用提纯得到的“精盐”配制100g 7.5%的氯化钠溶液。经检测,溶质质量分数偏小,其原因可能有(填序号)。
①氯化钠固体不纯 ②称量时精盐与砝码放反了
③量取水时俯视读数 ④装瓶时,有少量溶液洒出
-
(4) 查阅资料得知:粗盐中除含少量泥沙等不溶性杂质外,还含有少量的可溶性杂质(假定可溶性杂质只有MgCl2一种),为了得到较纯净的氯化钠,小组同学将所得的“精盐”又作了如下处理:

①白色沉淀的化学式为。
②在得到的滤液中加入足量的稀盐酸的目的是。
③若实验过程中不考虑损耗,最终到的NaCl固体的质量将(填“大于”、“小于”或“等于”)原精盐中NaCl的质量。
| 目的 | 主要操作方法 | |
| A | 粗盐的提纯(仅考虑不溶性杂质) | 溶解、过滤、洗涤、干燥 |
| B | 除去氮气中少量氧气 | 将混合物通过灼热的木炭 |
| C | 除去铁粉中少量的铜粉 | 加入足量硫酸铜溶液,过滤 |
| D | 鉴别蒸馏水和食盐水 | 用玻璃棒分别蘸取待测液在火焰上灼烧 |

据图判断下列说法错误的是( )
(实验目的)粗盐中难溶性杂质的去除
(实验过程)
①用天平称取5.0g粗盐,加入到盛有150mL水的烧杯里,用玻璃棒搅拌;
②过滤食盐水;
③将所得滤液倒入蒸发皿,加热并用玻璃棒搅拌,当液体蒸干时,停止加热;
④冷却后用玻璃棒把固体转移到纸上,称量,计算所得精盐的产率。
(实验分析)
-
(1) 步骤①中量取15.0mL正确读数方法:视线与保持水平;为节约能源实验中水的量不宜过多。步骤②得到的液体仍旧浑浊,请分析原因写一种。
-
(2) 如下图所示,步骤③中出现不正确操作,请改正,其中玻璃棒的作用是。

-
(3) 步骤④最终称得固体3.5g,则所得精盐的产率为。某学生在同等实验条件下,所得产品的产量明显比其他同学多,请帮他分析可能的原因。
A 步骤①中食盐未完全溶解 B.步骤②中有滤渣掉入承接液体的烧杯中
C.步骤③实验过程中有物质溅出 D.步骤④最终所得精盐比较潮湿
-
(1) 加入Na2CO3溶液的目的是什么?
-
(2) 最后制得氯化钠的质量大于粗盐中氯化钠的质量,写出一个可使氯化钠质量增加的化学方程式。
-
(3) 请设计实验方案证明操作③所得溶液中含有NaOH。(写出实验步骤和现象)
 、K+等杂质,某兴趣小组用该粗盐水经过下列实验流程制取纯净氯化钠晶体。
、K+等杂质,某兴趣小组用该粗盐水经过下列实验流程制取纯净氯化钠晶体。 
-
(1) 写出操作①的名称。
-
(2) 加碳酸钠溶液时发生反应的化学方程式。
-
(3) 若将溶液C蒸发至出现大量固体时停止加热,利用余热将溶液蒸干得到晶体,所得晶体仍不是纯净的氯化钠,请说明其原因。
-
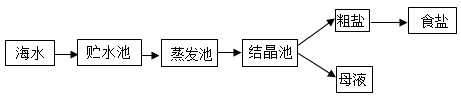
(1) 食盐的主要成分是。
-
(2) 蒸发池中,水蒸发属于(填“物理”或“化学”)变化。
-
(3) 下列是去除粗盐中难溶性杂质的操作,正确的顺序是____(填序号)。A . 过滤 B . 溶解 C . 蒸发



