粗盐提纯 知识点题库
有下列仪器,在实验中使用仪器的说法错误的是
(1)食盐、食醋、纯碱等均为家庭中常用的物质,利用这些物质你能完成的实验是①除去热水瓶中的水垢②鉴别食盐和纯碱③检验鸡蛋壳能否溶于酸( ).
A. ①② B. ①③ C. ① D. ①②③
(2)少量的植物油加入到盛水的试管中,振荡,观察到的现象是植物油浮于水面,该混合物叫做乳浊液,清洗这支试管用 洗涤,因为 有 的功能.
(3)若用大盐粒配制盐水,使大粒盐尽快溶解,可采取的两种方法是:
方法一: 方法二: .
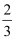


-
(1) 操作E中得到的滤液仍浑浊,其原因可能是(答出一点即可);
-
(2) 若图B所用的烧杯内壁沾有水,导致配制溶液中溶质的质量分数会(填“偏大”、“偏小”或“不变”);
-
(3) 图C中有一处明显的错误,请你改正:
-
(1) 根据如图信息,写出甲、乙两种元素的单质间发生反应的化学方程式:.

-
(2) 某同学将铁片放入CuSO4溶液中,发现铁片表面有红色物质析出,同时还有少量无色无味气泡产生.对于产生气泡的“异常现象”,下列猜想不合理的是 (填字母).A . 产生的气体可能是H2 B . 产生的气体可能是CO2 C . CuSO4溶液中可能含有少量的某种酸 D . CuSO4溶液的pH 小于7
-
(3) 某氯化钠溶液中含有较多CaCl2 , 按下图方案提纯得到氯化钠晶体.

①试剂A的化学式为.
②加入足量稀盐酸的目的是.
③操作Ⅰ、Ⅱ的名称分别是、.
④操作Ⅰ、Ⅱ中都要用到一种玻璃仪器,该仪器在操作Ⅱ中的作用是.
-
(4) 工业上常用电解饱和食盐水的方法制备氢氧化钠,产物除氢氧化钠外,还有氯气和氢气.若要制取200t氢氧化钠,理论上需要氯化钠的质量是多少?
【提出问题】;汗水中产生咸味的物质是什么?
【假设与猜想】:根据生活经验推测,汗水中产生咸味的物质可能是.
【查阅资料】:用铂丝蘸取少许含有钠元素的溶液(或物质)在酒精灯火焰上灼烧,会呈现黄色火焰.
【制订计划】:为了证明咸味物质是猜想中的物质,一是要证明汗水溶液中含有阴离子(填写离子符号),二是要证明汗水溶液中有阳离子(填写离子符号).
【进行实验】:
证明阴离子的实验:向汗水溶液中滴加溶液,再加入少量稀硝酸,振荡,仍有白色沉淀产生.
证明阳离子的实验:.
【结论】:经上述实验证明,汗水中的咸味物质就是猜想中的物质.
【分析与交流】:上述实验中,证明阴离子存在的化学反应方程式为:,该反应属于复分解反应.
选项 | 实验目的 | 实验操作 |
A | 验证 NaCl 溶液中混有盐酸 | 取少量溶液,滴加无色酚酞溶液 |
B | 比较 Fe、Cu、Ag的金属活动性 | 铁丝浸入CuSO4溶液,铜丝浸入AgNO3溶液 |
C | 除去铁制品上的铁锈 | 将铁制品浸泡在足量的稀硫酸中 |
D | 除去粗盐中的难溶性杂质 | 将粗盐研碎、溶解、蒸发 |

-
(1) 请按由上到下的顺序重新排列(填字母).调整后净化的盐水仍含可溶性杂质,他设计了下面的除杂流程:
-
(2) 如图2中步骤①②都需要进行操作,步骤④需要进行操作.

-
(3) 已知试剂X是碱溶液,则沉淀I为(写化学式),下列碱溶液不符合要求的是(填序号).
A.氢氧化钠溶液 B.氢氧化钡溶液
C.氢氧化钾溶液 D.氢氧化钙溶液
-
(4) 步骤②除去氯化钙的反应方程式是;步骤③中发生中和反应的化学方程式是.


①操作a、b、c依次为、、;
②三个操作中都用到的一种玻璃仪器是,这种仪器在操作b中所起的作用是;
③最后称得NaCl的质量偏低,则可能的原因有(填字母)。
A.过滤时滤纸有破损
B.蒸发时有固体溅出
C.溶解含有泥沙的粗食盐时,加入的水量不足
 测定食醋的pH
B .
测定食醋的pH
B .  夹持试管
C .
夹持试管
C .  除去粗盐中的CaCl2
D .
除去粗盐中的CaCl2
D .  加热较多液体
加热较多液体
Ⅰ.实验目的:体验初步提纯的实验过程。
Ⅱ.实验用品:玻璃棒、烧杯、蒸发皿.....
Ⅲ.实验过程:
实验步骤:①计算产率②过滤③称量与溶解④蒸发
正确的操作顺序应是(填序号)。
Ⅳ.在蒸发过程中,当蒸发皿中出现,停止加热。
Ⅴ.问题讨论:
①如果过滤后的滤液仍浑浊,其原因可能是(写出一条)。
②用托盘天平称量12.6g氯化钠时,向左盘中加入氯化钠后,发现指针向右偏转,应进行的操作是。
①氯化镁是易溶于水的白色固体,该描述是告知氯化镁的(选填“物理性质”或“化学性质”),写出氯化镁的化学式。
②用天平称取2g粗盐,用量筒量取10mL水。量筒的局部示意图如下,量取水时应沿视线(选填“a”或“b”)进行读数。

③按下图流程进行实验。

操作1、2、3都用到一种玻璃仪器是;操作2的名称为。若要计算经验的产率,还需进行的一步操作是。对上述实验过程,分析正确的是。
A粗盐和精盐都是混合物
B粗盐变成精盐属于化学变化
C溶解粗盐时,加入的水不宜过多,以免影响蒸发的时间
D为得到全部晶体,应把水分全部蒸干后,才停止加热


阴离子 阳离子 | OH﹣ |
| Cl﹣ |
|
|
K+ | 乙 | 丁 | 戊 | ||
Ba2+ | 甲 | 丙 |
-
(1) 探究活动一:认识工具
认识符号:NO
 的名称是;
的名称是; -
(2) 物质分类:五种物质中,属于碱的是(用化学式表示);
-
(3) 溶解能力:五种物质中,只有一种不溶于水,它是(用化学式表示);
-
(4) 相互反应:五种物质中,有两种物质在溶液中能相互反应,其化学方程式为。
-
(5) 探究活动二:运用工具
已知某氯化钠样品中,含有不溶性杂质(泥沙)和可溶性杂质(氯化镁、氯化钙)。为了得到纯净的氯化钠,某实验小组设计了下列实验方案,请你完成相关问题:

在上述实验方案中,操作Ⅰ、操作Ⅱ、操作Ⅲ都是将固体和溶液分离,该操作的名称是,在实验室中进行该操作用到的玻璃仪器有漏斗、烧杯、。
-
(6) 固体乙是,溶液B中的溶质有。(都用化学式表示)
-
(7) 通过上述设计可以看出,除去氯化钠中的可溶性杂质,实质上就是加入试剂把溶液中的(填离子符号)转化为难溶于水的物质,再进行分离而除去,在溶液C中加入适量的稀酸X是为了,写出其中一个反应的化学方程式。

部分物质在水中的溶解性表(室温)
阴离子 阳离子 | OH﹣ |
|
|
Ba2+ | 溶 | 不溶 | 不溶 |
Ca2+ | 微溶 | 微溶 | 不溶 |
Mg2+ | 不溶 | 溶 | 微溶 |
-
(1) 步骤二中使用的三种试剂为:①Na2CO3溶液②BaCl2溶液③NaOH溶液,依次加入试剂的顺序为(填序号)。
-
(2) 步骤二中加入足量NaOH溶液发生反应的化学方程式。
-
(3) 若经过滤,滤液仍浑浊的原因可能是(填序号)。
①滤纸破损
②液面高于滤纸边缘
③仪器不干净
-
(4) 步骤三操作X的名称是。用经X操作后得到的6gNaCl固体,配制溶质质量分数为6%的氯化钠溶液,所需水的质量为g。








