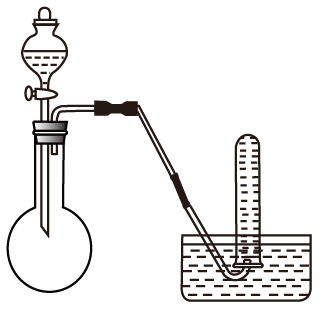
常见气体制备原理及装置选择 知识点题库
下列是实验室常见的气体制取、干燥和收集装置.若用过氧化氢和催化剂二氧化锰制取干燥的氧气,则合理的装置组合为( )

a.加热盛有药品的试管;
b.向试管中加入药品;
c.检查装置的气密性;
d.用排水法收集气体;
e.停止加热;
f.将导气管从水槽中取出
正确的操作顺序是( )
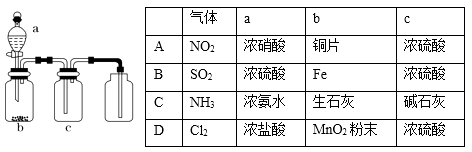
 配置一定浓度的硫酸
B .
配置一定浓度的硫酸
B .  制备少量氨气
C .
制备少量氨气
C .  制备并收集少量NO2气体
D .
制备并收集少量NO2气体
D .  制备少量氧气,并随关随停
制备少量氧气,并随关随停

-
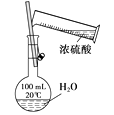
(1) 点燃酒精灯加热,能观察到的实验现象是。
-
(2) 由上述实验你能得出的结论是。
-
(3) 写出碳酸氢钠受热分解的化学方程式。
(制备FeBr2固体)
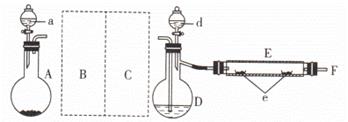
实验室用如图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时,先将干燥、纯净的CO2气流通入D中,再将铁粉加热至600—700℃,E管中铁粉开始反应。不断将d中液溴滴入温度为100—120℃的D中,经过一段时间的连续反应,在不锈钢管内产生黄绿色鳞片状溴化亚铁。
-
(1) 若在A中盛固体CaCO3 , a中盛有6 mol/L的盐酸。为使导入D中的CO2为干燥纯净的气体,则图中B、C处的洗气瓶中装有的试剂分别是:B中为,C中为。若进入E装置中的CO2未干燥,则可能发生的副反应的化学方程式为。
-
(2) E管中的反应开始后持续通入CO2的主要作用是。
(探究FeBr2的还原性)
-
(3) 已知:Cl2的CCl4溶液呈黄绿色,Br2的CCl4溶液呈橙红色。Cl2既能氧化Br- , 也能氧化Fe2+。取10 mL0.1mol/LFeBr2溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为血红色。另取少量反应后的溶液加入CCl4 , 振荡后,下层为无色液体。以上实验结论表明还原性:Fe2+Br-(填“>”或“<”)。
-
(4) 若在40 mL上述FeBr2溶液中通入标准状况下67.2 mL的 Cl2 , 取少量反应后的溶液加入CCl4 , 振荡后下层液体呈色,写出该反应的离子方程式。
-
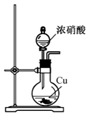
(1) 实验一:浓硫酸与铜反应

装置A中发生反应的化学方程式为;
当反应转移0.2mol电子时,生成气体在标况下的体积为L,被还原的硫酸为mol
-
(2) 装置D中试管口放置的棉花浸有NaOH浓溶液,其作用是;
-
(3) 装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中由于气压增大引发的现象是,B中应放置的溶液是。
A.水 B.酸性KMnO4溶液
C.浓溴水 D.饱和NaHSO3溶液
-
(4) 实验二:浓硫酸与碳反应,并验证反应生成的气体产物
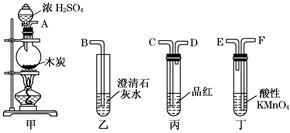
冯同学认为按照甲、丙、丁、乙的装置顺序,即可验证产物为SO2和CO2 , 那么丁中酸性KMnO4溶液的作用是;
-
(5) 陈同学认为丙装置要使用两次才能确保检验气体产物的准确性,如按该同学所说,气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
A————B;
能说明气体产物中有CO2的实验现象是①②。
 SiCl4+C)制取少量SiCl4(沸点57.6℃,易水解)。下列实验原理和装置不能达到实验目的的是( )
SiCl4+C)制取少量SiCl4(沸点57.6℃,易水解)。下列实验原理和装置不能达到实验目的的是( )
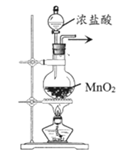 制取氯气
B .
制取氯气
B .  净化氯气,气体从接口①进入
C .
净化氯气,气体从接口①进入
C . 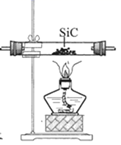 制取四氯化硅
D .
制取四氯化硅
D .  收集四氯化硅粗产品
收集四氯化硅粗产品
| A | B | C | D |
| | | | |
| 制备H2S | 制备NH3 | 制备NO2 | 制备Cl2 |
 +2H2O
+2H2O
-
(1) 用如图装置制备纯净的CO2
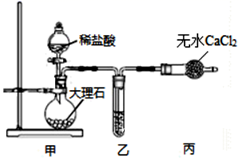
①甲装置中盛放稀盐酸的仪器名称是。
②丙装置的作用是。
-
(2) 按照下图进行实验(夹持装置略)。
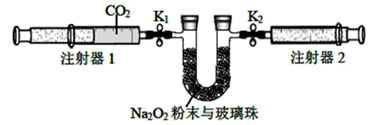
①先组装仪器,然后,再用注射器1抽取100 mL纯净的CO2 , 将其连接在K1处,注射器2的活塞推到底后连接在K2处,具支U形管中装入足量的Na2O2粉末与玻璃珠。
②打开止水夹K1、K2 , 向右推动注射器1的活塞,可观察到的现象是。
③实验过程中,需缓慢推入CO2 , 其目的是,反应的化学方程式。
-
(3) 实验结束后,当注射器1的活塞推到底时,测得注射器2中气体体积为65 mL,则反应消耗CO2的体积是。
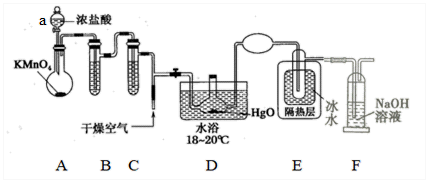
已知:①Cl2的熔点为-101℃,沸点是-34.6℃;②HgO+2Cl2=HgCl2+Cl2O
-
(1) 仪器a的名称是,装置A中制备Cl2的化学方程式为。
-
(2) 装置C的作用是。
-
(3) 通入干燥空气的目的是。
-
(4) 装置D与E之间不用橡胶管连接的原因是,NaOH溶液的作用是(用离子反应方程式表示)。
 B . 乙烯
B . 乙烯  C . 乙酸乙酯
C . 乙酸乙酯  D . 氢气
D . 氢气 
选项 | A | B | C | D |
实验目的 | 制备Cl2 | 制备并收集NO | 配制0.10 | 检验CO2中混有的CH4 |
实验试剂 | 浓盐酸和二氧化锰 | Cu和稀硝酸 | 水和NaOH(s) | I中澄清石灰水,II中溴水 |
实验装置 |
|
|
|
|

制备原理 | 除杂试剂(杂质) | |
A | CaCO3和盐酸制CO2 | 饱和NaHCO3溶液(HCl) |
B | MnO2和浓盐酸制Cl2 | 饱和食盐水(HCl) |
C | Na2SO3和硝酸制SO2 | 饱和NaHSO3溶液(HNO3) |
D | 浓氨水和烧碱制NH3 | 碱石灰(H2O) |
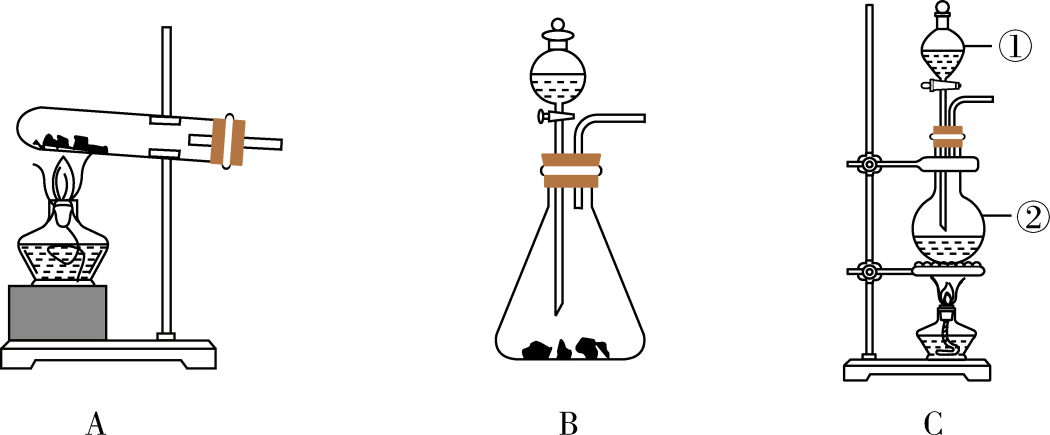
-
(1) 仪器②的名称是。
-
(2) 根据题目所提供药品,可利用装置B制备的气体是。
-
(3) 用C装置制备的气体离子方程式。
-
(4) 实验室也可利用装置B将浓氨水滴入生石灰制备NH3 , 写出该反应的化学方程式。
-
(5) 下列说法正确的是____。A . 四种气体均可以用无水CaCl2干燥 B . 在制备H2时,可滴加几滴CuSO4溶液以加快反应速率 C . 制备CO2时,稀盐酸可用稀硫酸代替 D . 足量二氧化锰与0.4L10.0mol/L浓盐酸反应,可生成标准状况下22.4L的Cl2 E . 若试剂任选,实验室制备O2可用装置A也可用装置B

| 选项 | 实验目的 | X中试剂 | Y中试剂 |
| A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
| B | 用Cu与浓硝酸制取并收集纯净干燥的NO2 | 水 | 浓硫酸 |
| C | 用大理石和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
| D | 锌和稀盐酸制取并收集纯净干燥的H2 | 水 | 浓硫酸 |
I.取适量碳酸铈[Ce2(CO3)3]于铂皿中,用硝酸溶解,配成一定浓度的硝酸铈溶液,过滤后待用。在搅拌条件下,向硝酸铈溶液中加入双氧水、氨水进行氧化沉淀,加热后过滤、洗涤、烘干得到Ce(OH)4(黃色难溶物)。
II.将Ce(OH)4于一定温度下加入硝酸加热至浆状,生成H2[Ce(NO3)6],再加入稍过量的NH4NO3晶体,二者反应生成硝酸高铈铵沉淀,经过滤、洗涤、自然烘干后得到产品。
回答下列问题:
-
(1) ①步骤I中使用铂皿而不使用铁质容器的原因是,写出生成Ce(OH)4的离子方程式:。
②步骤I中进行“氧化沉淀”时,加热的温度不宜过高,原因是。
-
(2) 步骤I中的Ce(OH)4在实验室中可由Ce(OH)3制取,某同学设计了如下装置: 。

①装置a圆底烧瓶中盛放的固体药品为(填化学式)。
②当装置b中沉淀完全变为黄色后,停止通Cl2后改通空气(图中框内改为通空气装置)的目的是;将装置b中的反应混合物过滤、洗涤,能说明沉淀已洗涤干净的实验方法是。
-
(3) 步骤II中H2[Ce(NO3)6]与NH4NO3反应的化学方程式为。


 NaOH溶液
NaOH溶液