配制一定物质的量浓度的溶液 知识点题库
反应阶段 | Ⅰ | Ⅱ | Ⅲ |
盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
现象 | 无气体 | 产生气体 | 无气体 |
请回答下列问题:
-
(1) 配制0.10mol•L﹣1的稀盐酸250mL,需要10.0mol•L﹣1的浓盐酸的体积为mL.
-
(2) 计算样品溶液中碳酸根离子的物质的量浓度.
-
(1) 请填写下面空白处.
A.在天平上称出 g硫酸钠固体,把它放在烧杯里,用适量的蒸馏水溶解.
B.把得到的溶液小心地沿着玻璃棒注入 mL的容量瓶中.
C.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中.
D.继续向容量瓶中加蒸馏水至液面距刻度1~2cm处,改用 小心滴加蒸馏水至溶液凹液面底部与刻度线水平相切.
E.将瓶塞塞紧,充分摇匀.
F.将配好的溶液倒入试剂瓶中,贴上标签,并洗涤容量瓶.
-
(2) 下列情况会使所配溶液浓度偏高的是 (填序号).
①容量瓶用前内壁沾有水珠 ②没有进行上述的操作步骤C
③未冷却到室温就注入容量瓶定容 ④定容时,水加多了,用滴管吸出
⑤定容时,仰视容量瓶刻度线 ⑥定容时,俯视容量瓶刻度线
-
(3) 如果实验室用98%的浓硫酸(密度为1.8g•cm﹣3) 配制 3.6mol•L﹣1的稀硫酸150mL.计算所需浓硫酸的体积为 mL.
-
(1) 该硫酸的物质的量浓度为 mol•L﹣1 .
-
(2) 某化学兴趣小组进行硫酸性质的实验探究时,需要100mL 3.0mol•L﹣1的稀H2SO4 , 则需取 mL的该硫酸,量取浓硫酸所用的量筒的规格是(从下列中选用).
A.10mL B.25mL C.50mL D.100mL
-
(3) 整个实验中所用到的玻璃仪器除烧杯、玻璃棒、量筒外还有:
-
(4) 下列情况对所配制的稀硫酸浓度有何影响(用“偏大”“偏小”或“无影响”填写)?
A.所用的浓硫酸长时间放置在密封不好的容器中.
B.未经冷却趁热将溶液注入容量瓶中:.
C.所用过的烧杯、玻璃棒未洗涤.
D.定容时俯视液面读数:.
-
(1) 准确称取氢氧化钠的质量
-
(2) 在配制过程中, 不会用到的实验仪器是(填字母)。
A.500mL容量瓶B.托盘天平C.圆底烧瓶D.烧杯E.玻璃棒F.锥形瓶,除上述仪器外,尚缺的玻璃仪器是
-
(3) 配制氢氧化钠溶液时,下列操作可能会使所配溶液物质的量浓度偏低的是________A . 所用NaOH固体已潮解 B . 容量瓶底有少量蒸馏水 C . 转移溶液过程中有少量液体溅出 D . 定容时俯视读数 E . 定容摇匀后,液面低于刻度线,继续滴加蒸馏水至刻度线
-
(1) 请写出该实验的实验步骤
①计算,②,③,④,⑤洗涤,⑥,⑦摇匀。
-
(2) 所需仪器为:容量瓶(规格:)、托盘天平、还需要那些玻璃仪器才能完成该实验,请写出:。使用容量瓶前必须进行的操作是。
-
(3) 试分析下列操作对所配溶液的浓度有何影响。(填“偏高”“偏低”“无影响”)
①为加速固体溶解,可稍微加热并不断搅拌。在未降至室温时,立即将溶液转移至容量瓶定容。对所配溶液浓度的影响:
②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶浓度的影响: 。
③某同学从该溶液中取出50mL,其中NaCl的物质的量浓度为。
 D .
D . 
A.把制得的溶液小心地转移至容量瓶中。
B.在天平上称取14.2g 硫酸钠固体,把它放在烧杯中,用适量的蒸馏水将它完全溶解并冷却至室温。
C.继续向容量瓶中加蒸馏水至液面距刻度1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
E.将容量瓶塞塞紧,充分摇匀。
请填写下列空白:
-
(1) 操作步骤的正确顺序为(填序号)。
-
(2) 本实验用到的基本仪器除烧杯、天平(砝码、镊子)、玻璃棒外,还有
-
(3) 下列情况中,会使所配溶液浓度偏低的是________________。A . 某同学观察液面时仰视 B . 没有进行上述的操作步骤D C . 加蒸馏水时,不慎超过了刻度线 D . 容量瓶使用前内壁沾有水珠
-
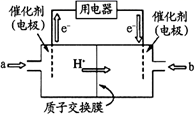
(4) 甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:通入a气体的电极是原电池的极(填 “正”或“负”),其电极反应式为。

-
(1) 该浓硫酸的物质的量浓度为。
-
(2) 某学生欲用上述浓硫酸和蒸馏水配制480mL0.500mol×L-1稀硫酸。
①配制稀硫酸时,选用仪器有量筒、烧杯、玻璃棒、。
②该学生需要用量筒量取mL,上述浓硫酸进行配制。
-
(3) 在配制过程中,下列实验操作对所配制的稀硫酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)。
①用量筒量取浓硫酸时仰视观察凹液面:。
②定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水:。.
-
(4) 该同学将所配制的0.500mol×L-1的硫酸溶液逐滴滴加到0.500mol×L-1Ba(OH)2溶液中,产生沉淀的质量与加入硫酸体积关系如图所示:
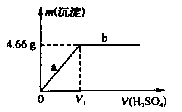
①该反应的离子方程式为。
②充分反应后生成沉淀质量为4. 66 g,则消耗Ba(OH)2溶液的体积为mL。
|
|
|
|
|
|
配制 |
除去 |
蒸馏用冷凝管 |
盛装 |
|
① |
② |
③ |
④ |
“84消毒液”:含25%NaClO、1000mL、密度1.192g·cm-3 , 稀释100倍(体积比)后使用。
-
(1) 该“84消毒液”的物质的量浓度约为mol·L-1。
-
(2) 某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=mol·L-1。
-
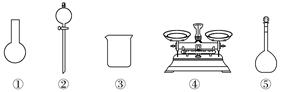
(3) 该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。下列说法正确的是_______(填字母)。A . 如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器 B . 容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制 C . 利用购买的商品NaClO来配制可能导致结果偏低 D . 需要称量NaClO固体的质量为142.8g
-
(4) “84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.8g·cm-3)的浓硫酸配制100mL物质的量浓度为0.8mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①需要用量筒量取mL上述浓硫酸进行配制。
②为配制上述稀硫酸,除了量筒、烧杯、玻璃棒外,还缺少的玻璃仪器是、。
③在配制过程中,下列实验操作可能导致配制的硫酸溶液浓度偏高的是(填序号)。
a.定容时俯视观察
b.定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
c.浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移
d.容量瓶未干燥即用来配制溶液
e.往容量瓶转移时,有少量液体溅出
f.未洗涤稀释浓硫酸的烧杯
-
(1) 若用质量分数为36.5%,密度为1.2g/cm3的浓盐酸配制100mL 5mol/L的稀盐酸,需要浓盐酸mL(保留小数点后1位)。
-
(2) 求算该氧化物的化学式(写出计算过程)。
I.准备标准溶液
a.配制100mLKMnO4溶液备用;
b.准确称取Na2C2O4基准物质3.35g(0.025mol),配制成250mL标准溶液。取出25.00mL于锥形瓶中,加入适量3mol·L-1硫酸酸化后,用待标定的KMnO4溶液滴定至终点,记录数据,计算KMnO4溶液的浓度。
II.滴定主要步骤
a.取待测双氧水10.00mL于锥形瓶中;
b.锥形瓶中加入30.00mL蒸馏水和30.00mL3mol·L-1硫酸,然后用已标定的KMnO4溶液(0.1000mol·L-1)滴定至终点;
e.重复上述操作两次,三次测定的数据如下表:
组别 | 1 | 2 | 3 |
消耗标准溶液体积(mL) | 25.24 | 25.02 | 24.98 |
d.数据处理。
回答下列问题:
-
(1) 将称得的Na2C2O4配制成250mL标准溶液,所使用的仪器除烧杯和玻璃棒外还有。
-
(2) 标定KMnO4溶液时,能否用稀硝酸调节溶液酸度(填“能”或“不能”),简述理由。写出标定过程中发生反应的化学方程式。
-
(3) 滴定待测双氧水时,标准溶液应装入滴定管,装入标准溶液的前一步应进行的操作是。
-
(4) 滴定双氧水至终点的现象是。
-
(5) 计算此双氧水的浓度为g·L-1.
-
(6) 若在配制Na2C2O4标准溶液时,烧杯中的溶液有少量溅出,则最后测定出的双氧水的浓度会(填“偏高”、“偏低”或“无影响”)。
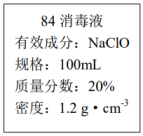
-
(1) 该品牌84消毒液中NaClO的物质的量浓度约为
 (保留一位小数)。
(保留一位小数)。
-
(2) 工业上用
 与浓氢氧化钠溶液反应制取84消毒液,请写出该反应的离子方程式。
与浓氢氧化钠溶液反应制取84消毒液,请写出该反应的离子方程式。
-
(3) 某同学欲在实验室配制
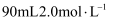 氢氧化钠溶液,用来制备该消毒液。
氢氧化钠溶液,用来制备该消毒液。①配置该溶液需要称量氢氧化钠固体的质量是g。
②配制过程中使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、。
③关于配制过程的说法正确的是(填字母)。
A.将称好的固体直接在容量瓶中加水溶解
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
C.定容时仰视容量瓶刻度线可能导致结果偏高
D.若加水超过刻度线,需要倒掉重新配置
-
(4) 定容时的操作:当液面接近容量瓶刻度线1~2cm时,,再将容量瓶塞盖好,反复上下颠倒,摇匀。
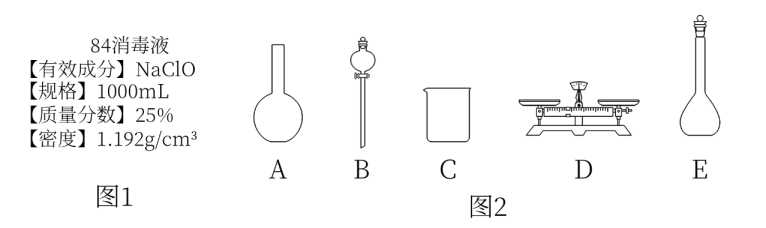
-
(1) 该“84消毒液”中NaClO的物质的量浓度为mol·L−1。
-
(2) 该同学欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。
①如图2所示的仪器中,配制此溶液不需要使用的是(填仪器序号),还缺少的是 (填仪器名称)。
②该同学配制上述溶液时需称量的NaClO固体的质量为g。
-
(3) 若实验遇下列情况,导致所配溶液的物质的量浓度偏低是____(填序号)。A . 容量瓶在使用前未干燥,里面有少量蒸馏水 B . 定容时仰视刻度线读数 C . 定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线 D . 未冷至室温就转移定容
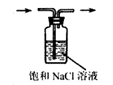

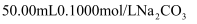 溶液
溶液 中的
中的 
 溶液的试剂瓶
溶液的试剂瓶


