配制一定物质的量浓度的溶液 知识点题库
某实验室需要配制480mL 0.10mol/L Na2CO3溶液.

(1)所需玻璃仪器有:玻璃棒、烧杯、100mL量筒、 、
(2)实验时图中所示操作的先后顺序为 (填编号)
(3)在配制过程中,下列操作对所配溶液浓度有无影响?(填“偏高”、“偏低”或“无影响”)
①称量时误用“左码右物”
②转移溶液后没有洗涤烧杯和玻璃棒
③向容量瓶加水定容时俯视液面
④摇匀后液面下降,再加水至刻度线
(4)所需Na2CO3固体的质量为 g;若改用浓溶液稀释,需要量取2mol/L Na2CO3溶液 mL.
-
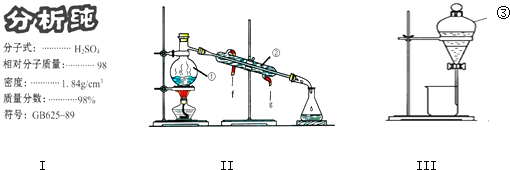
(1) 学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容如图Ⅰ,现欲用此硫酸配制配制成浓度为0.50mol•L﹣1的稀硫酸100mL.
①所需玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外还需.
②所取浓硫酸的体积为 mL.
-
(2) 写出上述装置Ⅱ中仪器的名称:②;③;
-
(3) 若利用装置Ⅱ分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有,将仪器补充完整后进行的实验操作的名称为.
-
(4) 实验室常用装置Ⅲ分离碘水中的碘,该实验操作名称为.进行该操作时,需在碘水中加一试剂,在选择试剂时,下列性质你认为哪些性质是必需的:(填序号).
①常温下为液态 ②I2在其中溶解程度大 ③与水互不相容 ④密度要比水大.
-
(1) 用98%的浓硫酸(其密度为1.84g/cm3)配制240mL1.0mol•L﹣1稀硫酸,若实验仪器有:量筒、烧杯、玻璃棒
(i)需量取浓硫酸的体积为 mL.
(ii)实验时需用的仪器还有.
(iii)配制过程中,下列情况会使配制结果偏高的是(填序号)
①称量时,托盘天平左盘加砝码,右盘加氯化钠 ②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④移液后未洗涤烧杯和玻璃棒.⑤定容时俯视刻度线观察液面
-
(2) 请计算28g KOH固体必须溶解在 g水中,才能使每108个水分子中有1个K+ , 所得溶液的密度为ρ g•cm﹣3 , 则该溶液中OH﹣的物质的量浓度为.(保留到小数点后两位)
-
(1) 配制过程中需玻璃仪器有:烧杯、量筒、胶头滴管、、.
-
(2) 要完成本实验应称量NaOH固体的质量是.
-
(3) 配制溶液时,一般可以分为以下几个步骤:①计算;②称量;③;④冷却;⑤转移;⑥;⑦定容;⑧倒转摇匀.
-
(4) 如图装置是某同学配制此溶液时转移操作的示意图,图中的错误是.
-
(5) 在配制过程中,如果其他操作都是正确的,下列操作会引起浓度偏低的是.
①容量瓶不干燥,含有少量蒸馏水
②定容时俯视刻度线
③转移溶液时不慎有少量溶液洒到容量瓶外面
④定容摇匀后发现液面低于刻度线,再补加少量蒸馏水至刻度线
-
(6) NaOH溶液配制完成后,取100mL该溶液与100mL盐酸溶液混合,恰好完全中和,则该盐酸溶液的物质的量浓度为 mol•L﹣1 .
-
(1) 配制时,没有使用的仪器和用品有(填序号),还缺少的仪器是.
-
(2) 在配制的转移过程中某学生进行如图操作,请指出其中的错误:、
-
(3) 下列操作会使配制的溶液浓度偏低的是 (填字母)A . 没有将洗涤液转移到容量瓶 B . 转移过程中有少量溶液溅出 C . 容量瓶洗净后未干燥 D . 定容时俯视刻度线
-
(4) 在容量瓶使用方法中,下列操作不正确的是(填序号)A . 使用容量瓶前检查它是否漏水 B . 容量瓶用蒸馏水洗净后,再用碱液润洗 C . 将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中 D . 定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
-
(5) 实验中还需要2mol/L的NaOH溶液950mL,配制时应选用的容量瓶的规格和称取NaOH的质量分别是(填序号)
A.1000mL,80g B.950mL,76g
C.任意规格,72g D.500mL,42g.
 称量NaOH固体
B .
称量NaOH固体
B .  配制100mL0.1mol/L的H2SO4溶液
C .
配制100mL0.1mol/L的H2SO4溶液
C .  家里的食用胡麻油不小心混入了大量的水采取的分离方法
D .
家里的食用胡麻油不小心混入了大量的水采取的分离方法
D . 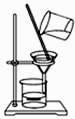 提纯Fe(OH)3胶体
提纯Fe(OH)3胶体
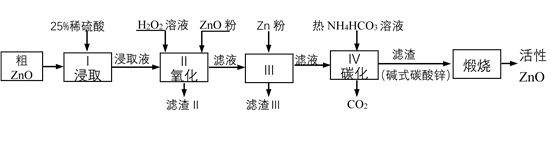
已知各相关氢氧化物沉淀pH范围如下表所示:
| Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
| 完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
完成下列填空:
-
(1) 步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,所需的仪器除玻璃棒、烧杯、量筒外,还需要______(选填编号)A . 天平 B . 滴定管 C . 容量瓶 D . 胶头滴管
-
(2) 步骤II中加入H2O2溶液的作用是(用离子方程式表示);
-
(3) 用ZnO调节pH,以除去含铁杂质,调节pH的适宜范围是。
-
(4) 步骤III中加入Zn粉的作用是:①;②进一步调节溶液pH。
-
(5) 碱式碳酸锌[Zn2(OH)2 CO3]煅烧的化学方程式为。
-
(6) 用如下方法测定所得活性氧化锌的纯度(假设杂质不参与反应):
①取1.000g活性氧化锌,用15.00mL 1.000mol·L-1硫酸溶液完全溶解,滴入几滴甲基橙。②用浓度为0.5000mol·L-1的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL。判断滴定终点的依据是;所得活性氧化锌的纯度为。
(配制KMnO4标准溶液)如图所示是配制50 mL KMnO4标准溶液的过程示意图。

-
(1) 请你观察图示判断,其中错误的操作有(填序号)。
-
(2) 其中确定50 mL溶液体积的容器是(填名称)。
-
(3) 如果用图示的操作配制溶液,所配制的溶液浓度将(填“偏大”或“偏小”)。
(测定血液样品中Ca2+的浓度)抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
-
(4) 已知草酸跟KMnO4反应的离子方程式为2MnO4-+5H2C2O4+6H+===2Mnx++10CO2↑+8H2O,则方程式中的x=。
-
(5) 经过计算,血液样品中Ca2+的浓度为mg/cm3。
-
(1) 该“84消毒液”的物质的量浓度为mol·L−1。
-
(2) 该同学取100 mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=mol·L−1。
-
(3) 一瓶“威露士”牌“84消毒液”能吸收空气中L的CO2(标准状况)而变质。(已知:CO2+2NaClO+H2O=Na2CO3+2HClO)
-
(4) 该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480mL含25%NaClO的消毒液。下列说法正确的是____。
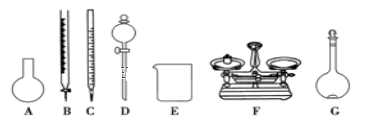 A . 如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器 B . 容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制 C . 利用购买的商品NaClO来配制可能导致结果偏低 D . 需要称量的NaClO固体质量为143g
A . 如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器 B . 容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制 C . 利用购买的商品NaClO来配制可能导致结果偏低 D . 需要称量的NaClO固体质量为143g
-
(1) 配制溶液时,必须使用的仪器有一定规格的容量瓶、烧杯、胶头滴管、天平和;
-
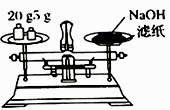
(2) 要完成本实验该同学应准确称量NaOHg;
-
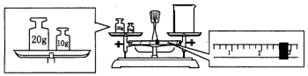
(3) 某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图,烧杯的实际质量为g;
-
(4) 下列对容量瓶及其使用方法的描述中正确的是_______。A . 容量瓶上标有容积、温度和浓度 B . 容量瓶用蒸馏水洗净后,必须烘干 C . 配制溶液时,把烧杯中的溶液小心倒入容量瓶中,加入蒸馏水到接近刻度线1~2cm处,改用胶头滴管加蒸馏水至刻度线 D . 使用前要检查容量瓶是否漏水
-
(5) 在配制过程中,下列操作可引起所配溶液浓度偏低的有(填序号)。
①未洗涤配溶液时用的烧杯;
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中;
③转移前,容量瓶中含有少量蒸馏水;
④定容时,仰视刻度线。

回答下列问题:
-
(1) 配制该溶液的实验步骤的正确排序为
-
(2) ①中称取Na2CO3固体时,质量为g。
-
(3) 玻璃棒在④中的作用分别是、
-
(4) 若出现如下情况,对所配溶液浓度有何影响?(填“偏高”或“偏低”或“无影响”)
A.某同学在第②步使用胶头滴管定容时俯视刻度线;
B.没有进行第③步操作;
C.第④步操作不慎有少量液体流到容量瓶外;
D.第⑤步操作完成后发现液面低于刻度线,又加入少量水;
E.容量瓶在使用前未进行干燥;
F.称取Na2CO3固体时,若将物品与砝码放在了错误的托盘上。



