配制一定物质的量浓度的溶液 知识点题库
-
(1) 该同学准备的实验用品有:托盘天平(带砝码)、药匙、量筒、玻璃棒等,还缺少的玻璃仪器有;
-
(2) 下列有关实验操作,正确的是 ;A . 称量氢氧化钠固体时,要在天平的左右两个托盘上分别放置两个相同规格的小烧杯 B . 某同学将称量的氢氧化钠固体溶解并冷却至室温,然后转移到容量瓶中 C . 某同学在定容时,不小心加水超过刻度线,又将多余的液体吸出直至刻度线 D . 某同学在溶解、转移完氢氧化钠溶液后,将溶解用的仪器洗涤2~3次,并将洗涤液转移到容量瓶中
-
(3) 在溶液的配制过程中,有以下基本实验步骤,其中,需要进行2次及以上的操作步骤是(填写操作步骤的代号).
①转移 ②洗涤 ③溶解 ④称量 ⑤定容 ⑥冷却
-
(4) 玻璃棒在该实验中的作用有①,②.
-
(5) 若实验室遇到下列情况,对氢氧化钠溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不影响”)
①称量氢氧化钠时,直接放到托盘天平上称量.;
②定容摇匀后,有少量溶液外流,所配溶液的浓度.
-
(1) 该同学准备的实验用品有:托盘天平(带砝码)、药匙、量筒、玻璃棒等,还缺少的玻璃仪器有、、.
-
(2) 下列有关实验操作,正确的是 .A . 称量氢氧化钠固体时,要在天平的左右两个托盘上分别放置两个相同规格的小烧杯 B . 某同学将称量的氢氧化钠固体溶解并冷却至室温,然后转移到容量瓶中 C . 某同学在定容时,不小心加水超过刻度线,又将多余的液体吸出直至刻度线 D . 某同学在溶解、转移完氢氧化钠溶液后,将溶解用的仪器洗涤2~3次,并将洗涤液转移到容量瓶中
-
(3) 玻璃棒在该实验中的作用有
①;
②.
-
(4) 若实验室遇到下列情况,对氢氧化钠溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”):
①称量氢氧化钠时,直接放到托盘天平上称量.
②定容摇匀后,有少量溶液外流,所配溶液的浓度.
|
| 目的 | 操作 |
| A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶 |
| B. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
| C. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
| D. | 配制浓度为0.010mol/L的KMnO4溶液 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |

-
(1) 在下图所示仪器中,配制上述溶液肯定不需要的是(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 。
-
(2) 在容量瓶的使用方法中,下列操作错误的是____________。A . 使用容量瓶前检验是否漏水。 B . 容量瓶用水洗净后,再用待配溶液洗涤。 C . 配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 D . 配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 E . 盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
-
(3) 根据计算用托盘天平称取的质量为g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度0.1mol/L(填“大于”“小于”或“等于”)。
-
(4) 根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为mL。
-
(1) 有关物质的量浓度的配制下列说法正确的是___A . 称取2.0gNaOH固体:先在托盘各放1张滤纸,然后在右盘加2g砝码,左盘加NaOH固体 B . 容量瓶上标有温度和容积使用前要检查是否漏水 C . 称取16.0gCuSO4 固体在500mL容量瓶中加水溶解后定容,可配得0.20mol/L的CuSO4溶液 D . 配制硫酸溶液时,可先在量筒中加入一定体积的水,再慢慢注入浓硫酸 E . 配制溶液时,俯视容量瓶刻度线造成浓度偏高 F . 溶液转移定容时,溶液未冷却至室温造成浓度偏低
-
(2) 海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(每一步所加试剂均过量):
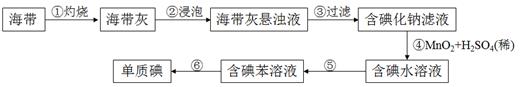
现有下列仪器,请按要求填写以下空白:
Ⅰ.步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,图中还缺少的玻璃仪器是。
Ⅱ.如何检验步骤③操作后碘化钠滤液中的碘离子,步骤⑤所需的操作名称是__。
Ⅲ.写出步骤④的化学反应方程式。
-
(1) ①如图所示的仪器中配制溶液肯定不需要的是(填字母),
②配制上述溶液还需用到的玻璃仪器是(填仪器名称)。
③下列有关容量瓶使用说法错误的是()
a.容量瓶使用前一定要检查是否漏液。其操作为装水盖上瓶塞→倒立观察是否漏夜→正立→玻璃塞旋转180°→再倒立观察是否漏夜。
b.不能作为反应容器或长期贮存溶液的容器;但是可以配制任意体积的溶液。
c.不能将固体或浓溶液直接在容量瓶中溶解或稀释;不能加入过冷或过热的液体 。
d.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小。
-
(2) 在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度(填“>”、“<”或“=”)0.1 mol·L-1;
③若NaOH固体溶解后立即移入容量瓶→洗涤烧杯和玻璃棒→洗涤液移入容量瓶→定容,则所得溶液浓度(填“>”、“<”或“=”) 0.1 mol·L-1。
-
(3) 在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为(计算结果保留一位小数)mL;
②如果实验室有15 mL、50 mL、100 mL量筒,应选用mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是。
-
(1) 选择仪器:完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、、等。
-
(2) 计算、称量,需称量NaOH固体的质量为。
-
(3) 溶解、冷却,该步实验中需要使用玻璃棒,作用是。
-
(4) 转移、洗涤,洗涤烧杯2~3次是为了。
-
(5) 定容、摇匀,定容的具体操作是。
-
(6) 不规范的实验操作会导致实验结果的误差,下列使所配溶液的物质的量浓度偏高的是,偏低的是(填字母序号)。
A、容量瓶洗净后未烘干
B、在溶解过程中有少量液体溅出烧杯外
C、定容时俯视刻度线
D、将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容
E、定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
-
(1) Ⅰ.实验室配制490mL0.3mol/L的NaOH溶液
需称量NaOH固体g
-
(2) 在该溶液的配制过程中,用到的玻璃仪器:量筒、烧杯、玻璃棒。
-
(3) 如果在定容时仰视,溶液浓度将;(填“偏大”“偏小”“不影响” )
-
(4) Ⅱ、取上述实验中配制的NaOH溶液200mL,缓慢通入一定量的CO2 , 充分反应,测最后溶液的pH>7。在上述所得溶液中,逐滴缓慢滴加一定浓度的盐酸,所得气体的体积与所加盐酸的体积(不考虑溶解于水)关系如图所示:
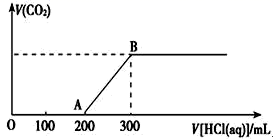
加入盐酸200mL之前,无气体产生,写出OA段发生反应的离子方程式。
-
(5) A点时,反应所得溶液中溶质的成分有
-
(6) 产生的CO2在标准状况下的体积为mL。

 固体配制900mL 0.05mol·L-1的
固体配制900mL 0.05mol·L-1的  溶液。
溶液。 回答下列问题:
-
(1) 计算并称量
 固体的质量为g,该实验中必须用到的标有温度的玻璃仪器是。
固体的质量为g,该实验中必须用到的标有温度的玻璃仪器是。
-
(2) 下列实验操作规范的是(填标号)。

-
(3) 下列情况会使所配制的
 溶液浓度偏大的是____________(填标号)
A . 未洗涤烧杯和玻璃棒 B . 将溶解后的溶液转移至容量瓶之前,容量瓶未干燥,含有少量蒸馏水 C . 定容时俯视刻度线 D . 定容时,发现液面超过刻度线,用吸管将多余的溶液吸出
溶液浓度偏大的是____________(填标号)
A . 未洗涤烧杯和玻璃棒 B . 将溶解后的溶液转移至容量瓶之前,容量瓶未干燥,含有少量蒸馏水 C . 定容时俯视刻度线 D . 定容时,发现液面超过刻度线,用吸管将多余的溶液吸出 -
(4) 取所配制的
 溶液1.0 mL于试管中,向其中滴加稀硫酸和KI溶液,发现溶液由紫色变成棕黄色,测知有
溶液1.0 mL于试管中,向其中滴加稀硫酸和KI溶液,发现溶液由紫色变成棕黄色,测知有  和
和  生成,则反应的离子方程式为。
生成,则反应的离子方程式为。
| 硫酸 化学纯(CP) (500 mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84 g·cm-3 质量分数:98% |
-
(1) 配制240mL 0.0100mol/L KMnO4标准溶液,若使用分析天平需要KMnO4固体质量为g(保留4位有效数字),需要使用烧杯、量筒、玻璃棒,还缺少的玻璃仪器为(填名称)。
-
(2) 酸化KMnO4溶液可选用的酸是,KMnO4标准溶液应置于(填 “酸式”或“碱式”)滴定管中,原因是。
-
(3) KMnO4和Na2C2O4在酸性条件下反应的离子方程式为。
-
(4) 到达滴定终点的实验现象是。
-
(5) 根据实验数据计算,软锰矿中MnO2的质量分数为%。

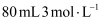 稀硫酸,操作步骤如下:量取质量分数为
稀硫酸,操作步骤如下:量取质量分数为 (密度为
(密度为 )的浓硫酸
)的浓硫酸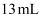 , 将浓硫酸沿烧杯内壁缓缓注入盛有蒸馏水的烧杯中,并不断用玻璃棒搅拌,将已冷却的浓硫酸沿容量瓶内壁缓缓注入容量瓶中,用蒸馏水洗涤烧杯和玻璃棒,洗涤液转移至容量瓶中,重复操作
, 将浓硫酸沿烧杯内壁缓缓注入盛有蒸馏水的烧杯中,并不断用玻璃棒搅拌,将已冷却的浓硫酸沿容量瓶内壁缓缓注入容量瓶中,用蒸馏水洗涤烧杯和玻璃棒,洗涤液转移至容量瓶中,重复操作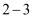 次,继续用烧杯向容量瓶中加入蒸馏水,使溶液的凹液面恰好与刻度线相切,盖上瓶塞后摇匀,装入试剂瓶中。实验操作中存在的错误有几处?( )
次,继续用烧杯向容量瓶中加入蒸馏水,使溶液的凹液面恰好与刻度线相切,盖上瓶塞后摇匀,装入试剂瓶中。实验操作中存在的错误有几处?( )
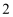 处
B .
处
B .  处
C .
处
C .  处
D .
处
D .  处
处



