物质的量浓度 知识点题库
100毫升0.3摩尔/升Na2SO4溶液和50毫升0.2摩尔/升Al2(SO4)3溶液混合后,溶液中SO42﹣离子的物质的量浓度为( )
A . 0.20摩尔/升
B . 0.25摩尔/升
C . 0.40摩尔/升
D . 0.50摩尔/升
下列溶液中Cl﹣的物质的量浓度最大的是( )
A . 50mL 0.5mol/L AlCl3溶液
B . 100mL 0.5mol/L MgCl2溶液
C . 100mL1mol/L NaCl溶液
D . 50mL0.5mol/L HCl溶液
质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水.得到的溶液每毫升质量为q g,物质的量浓度为c.则溶质的分子量(相对分子质量)为( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
若20g密度为ρ g•cm﹣3的硝酸钙溶液里含1g Ca2+ , 则NO3﹣的物质的量浓度是( )
A .  mol•L﹣1
B .
mol•L﹣1
B .  mol•L﹣1
C . 2.5ρ mol•L﹣1
D . 1.25ρ mol•L﹣1
mol•L﹣1
C . 2.5ρ mol•L﹣1
D . 1.25ρ mol•L﹣1
 mol•L﹣1
B .
mol•L﹣1
B .  mol•L﹣1
C . 2.5ρ mol•L﹣1
D . 1.25ρ mol•L﹣1
mol•L﹣1
C . 2.5ρ mol•L﹣1
D . 1.25ρ mol•L﹣1
有体积相同的两份营养液,其配方如下:
KCl | K2SO4 | ZnSO4 | ZnCl2 | |
第一份 | 0.3mol | 0.2mol | 0.1mol | ﹣﹣ |
第二份 | 0.1mol | 0.3mol | ﹣﹣ | 0.1mol |
两份营养液中各离子浓度( )
A . 完全不同
B . 完全相同
C . 仅c(K+)相同
D . 仅c(Cl-)相同
下列溶液中Cl﹣浓度最大的是( )
A . 800mL0.5mol/L的NaCl溶液
B . 100mL0.3mol/L的AlCl3溶液
C . 500mL0.3mol/L的CaCl2溶液
D . 300mL0.3mol/L的MgCl2溶液
由硫酸钾、硫酸铝钾和硫酸组成的混合溶液,其pH=1,c(K+)=0.3mol•L﹣1 , c(SO42﹣)=0,8mol•L﹣1 , 则c(Al3+)为( )
A . 0.15 mol•L﹣1
B . 0.2 mol•L﹣1
C . 0.3 mol•L﹣1
D . 0.4 mol•L﹣1
已知FeS溶于盐酸中,生成FeCl2和H2S气体。现将8.8g FeS固体置于200mL、2.0mol•L﹣1的盐酸中,以制备H2S气体。反应完全后,若溶液中H2S的浓度为0.10mol•L﹣1 , 假定溶液体积不变,试计算:
-
(1) 收集到标准状况下H2S气体的体积
-
(2) 溶液中Fe2+物质的量浓度
下列叙述正确的是( )
A . 置换反应一定是氧化还原反应
B . NH3是电解质
C . 物质的量浓度的单位是摩尔
D . 坩埚、试管、蒸发皿、烧瓶都可以用酒精灯直接加热
V L浓度为1.000 mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )
A . 向原溶液中通入常温常压下的HCl气体22.4V L,使其完全溶解
B . 将溶液加热浓缩到0.5V L
C . 向原溶液中加入10.00 mol·L-1的盐酸0.2V L,再稀释至1.5V L
D . 向原溶液中加入V L 3 mol·L-1的盐酸混合均匀
完成以下填空:
-
(1) 49g 硫酸完全电离时产生H+物质的量为mol。
-
(2) 8g NaOH溶于g水中,才能使每10个水分子中溶有一个钠离子。
-
(3) 标准状况下,2.4g某气体的体积为672mL,则此气体的摩尔质量为。
-
(4) 已知V L硫酸铁溶液中含Fe3+ a g,则溶液中Fe3+的物质的量浓度为mol/L,若将该溶液加水稀释到3V L,则溶液中
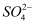 的物质的量浓度为mol/L。
的物质的量浓度为mol/L。
在配制一定物质的量浓度的溶液的实验中,下列操作正确的是( )
A . 将NaOH固体放在天平托盘的称量纸上,精确称量并放入烧杯中溶解后,立即注入容量瓶中
B . 将量取的18.4mol·L-1浓硫酸10mL,注入已盛有30 mL水的100 mL容量瓶中,加入至刻度线即可
C . 仰视容量瓶刻度线,看到液面超过了容量瓶刻度线,用胶头滴管吸出刻度线以上的溶液
D . 配制1000 mL 0.1 mol·L-1的盐酸,将稀释后的盐酸溶液全部转移到未经干燥的1000 mL的容量瓶中,加水至刻度线
现将AlCl3、MgCl2、MgSO4、Al2(SO4)3四种物质溶于水,形成的混合溶液中c(Al3+)=0.1 mol•L﹣1、c(Mg2+)=0.25 mol•L﹣1、c(Cl﹣)=0.2 mol•L﹣1 , 则该溶液中c(SO42-)为( )
A . 0.15 mol•L﹣1
B . 0.2 mol•L﹣1
C . 0.25 mol•L﹣1
D . 0.30 mol•L﹣1
取100mL 0.3mol/L硫酸溶液和300mL 0.25mol/L的硫酸溶液注入500mL容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是( )
A . 0.21mol/L
B . 0.42mol/L
C . 0.56mol/L
D . 0.26mol/L
设NA表示阿伏加德罗常数,下列说法正确的是 ( )
A . 1 mol氦气中有2NA个氦原子
B . 14 g氮气中含NA个氮原子
C . 2 L 0.3 mol·L-1Na2SO4溶液中含0.6 NA个Na+
D . 18 g水中所含的电子数为8NA
现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg/mol,若阿伏加德罗常数用NA表示,则:
-
(1) 该气体所含原子总数为 个。
-
(2) 该气体若溶于1L水中(不考虑反应),设溶液的密度为ρg/cm3 , 则该溶液的物质的量浓度为 mol/L。
下列关于物质的量浓度表述正确的是( )
A .  的
的  溶液中
溶液中  的物质的量浓度为
的物质的量浓度为  B . 22.4L氨气溶于水制得的1L氨水中,溶质的物质的量浓度为
B . 22.4L氨气溶于水制得的1L氨水中,溶质的物质的量浓度为 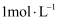 C . 将9.5 g MgCl2固体溶于少量水,再加水稀释至100mL,所得溶液中
C . 将9.5 g MgCl2固体溶于少量水,再加水稀释至100mL,所得溶液中  D . 向10mL5mol/L NaOH溶液中加入90mL水,所得溶液中溶质的物质的量浓度为0.5mol/L
D . 向10mL5mol/L NaOH溶液中加入90mL水,所得溶液中溶质的物质的量浓度为0.5mol/L
 的
的  溶液中
溶液中  的物质的量浓度为
的物质的量浓度为  B . 22.4L氨气溶于水制得的1L氨水中,溶质的物质的量浓度为
B . 22.4L氨气溶于水制得的1L氨水中,溶质的物质的量浓度为 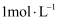 C . 将9.5 g MgCl2固体溶于少量水,再加水稀释至100mL,所得溶液中
C . 将9.5 g MgCl2固体溶于少量水,再加水稀释至100mL,所得溶液中  D . 向10mL5mol/L NaOH溶液中加入90mL水,所得溶液中溶质的物质的量浓度为0.5mol/L
D . 向10mL5mol/L NaOH溶液中加入90mL水,所得溶液中溶质的物质的量浓度为0.5mol/L
A、B、C、D是四种常见气体单质。E的相对分子质量比F小16,且F为红棕色。有关的转化关系如图1所示(反应条件与部分反应的生成物略去)。

请回答下列问题:
-
(1) Y的化学式为。
-
(2) Y与氧化铜反应,每生成1molB消耗3mol氧化铜,该反应的化学方程式为。
-
(3) Y与E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为。
-
(4) 气体F和气体SO2在通常条件下同时通入盛有BaCl2溶液的洗气瓶中(如图2所示),洗气瓶中白色沉淀是。
-
(5) 标准状况下,将NO2充满干燥烧瓶,将烧瓶倒置于水中,瓶内液面逐渐上升,假设烧瓶内溶液不扩散,则最终该溶液中溶质的物质的量浓度为mol·L﹣1(分数或小数表示均可)
下列反应的生成物不受反应物的用量或浓度或反应条件影响的是( )
A . SO2与NaOH溶液反应
B . Na与O2的反应
C . Cu在S蒸气中燃烧
D . Fe粉加入HNO3中
下列溶液Cl-物质的量浓度与200mL1mol·L-1AlCl3溶液中Cl-物质的量浓度相等的是( )
A . 150mL3mol·L-1NaClO溶液
B . 75mL3mol·L-1CaCl2溶液
C . 150mL3mol·L-1KCl溶液
D . 150mL2mol·L-1MgCl2溶液
最近更新



