物质的量的相关计算 知识点题库
标准状况下,112mL某气体的质量为0.14g,则其摩尔质量为.
核内中子数为N的R2+离子,质量数为A,则ng它的氧化物中所含质子的物质的是( )
A . 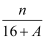 (A﹣N+8)mol
B .
(A﹣N+8)mol
B . 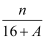 (A﹣N+10)mol
C . (A﹣N+2)mol
D .
(A﹣N+10)mol
C . (A﹣N+2)mol
D . 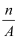 (A﹣N+6)mol
(A﹣N+6)mol
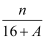 (A﹣N+8)mol
B .
(A﹣N+8)mol
B . 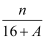 (A﹣N+10)mol
C . (A﹣N+2)mol
D .
(A﹣N+10)mol
C . (A﹣N+2)mol
D . 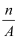 (A﹣N+6)mol
(A﹣N+6)mol
有关物质的量的下列说法正确的是( )
A . 物质的量就是指物质的数量
B . 硫酸的摩尔质量为98g
C . 标准状况下,0.5mol CCl4的体积为11.2L
D . 20.00 mL 0.5 mol/L的Ca(NO3)2溶液中NO3﹣的物质的量为0.02 mol
下列叙述错误的是( )
①一束平行光线照射蛋白质溶液时,从侧面可看到光亮的通路
②一定温度和压强下,气体体积主要由其分子的物质的量决定
③气体摩尔体积是指单位物质的量气体所占的体积,其单位是L
④在同温同体积时,气体的物质的量越大,则压强越大
⑤蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
⑥标准状况下,将1g铝片投入20mL 18mol/L的硫酸中,铝片完全溶解.
A . ①②④
B . ③⑤⑥
C . ②③⑥
D . ②④⑤
9.03×1023 个硝酸分子含mol电子,其中所含氧原子数与克CO2中所含氧原子数相等;46g X2O4中含有2.0mol氧原子,则X的摩尔质量为.
下列关于1.0mol·L-1的NaCl溶液说法正确的是( )
A . 溶液中含1mol NaCl
B . 1L溶液中含58.5克NaCl
C . 1mol NaCl溶于1L水中
D . 58.5克NaCl溶于941.5克水中
某氯原子的质量是a g ,12C原子的质量是b g ,用NA表示阿伏加德罗常数,下列说法中正确的是( )
①氯元素的相对原子质量一定是 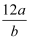 ② m g该氯原子的物质的量一定是
② m g该氯原子的物质的量一定是  mol③该氯原子的摩尔质量是aNA g/ mol④ a g该氯原子所含质子数是17NA
mol③该氯原子的摩尔质量是aNA g/ mol④ a g该氯原子所含质子数是17NA
A . ①③
B . ①④
C . ②③
D . ②④
NA代表阿伏加德罗常数的值,下列叙述正确的是( )
A . 1molHNO3作为氧化剂得到的电子数一定为3NA
B . 0.4mol/LNa2SO4溶液中,所含的Na+和  总数为1.2NA
C . 12g NaHSO4在熔融状态下可以电离出的阳离子数目0.2NA
D . 常温常压下,16gO3与O2的混合物中含有氧原子数为NA
总数为1.2NA
C . 12g NaHSO4在熔融状态下可以电离出的阳离子数目0.2NA
D . 常温常压下,16gO3与O2的混合物中含有氧原子数为NA
 总数为1.2NA
C . 12g NaHSO4在熔融状态下可以电离出的阳离子数目0.2NA
D . 常温常压下,16gO3与O2的混合物中含有氧原子数为NA
总数为1.2NA
C . 12g NaHSO4在熔融状态下可以电离出的阳离子数目0.2NA
D . 常温常压下,16gO3与O2的混合物中含有氧原子数为NA
常温下,在 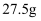 水中溶解
水中溶解 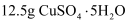 ,恰好达到饱和,该溶液密度为
,恰好达到饱和,该溶液密度为 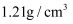 ,求:(要求有计算过程)
,求:(要求有计算过程)
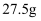 水中溶解
水中溶解 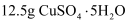 ,恰好达到饱和,该溶液密度为
,恰好达到饱和,该溶液密度为 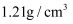 ,求:(要求有计算过程)
,求:(要求有计算过程)
-
(1) 该溶液中
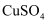 的质量分数是
的质量分数是
-
(2) 该溶液中
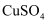 的物质的量浓度是(计算结果保留到小数点后两位)
的物质的量浓度是(计算结果保留到小数点后两位)
0.6mol O2与0.4mol O3的质量之比为,分子个数之比为,O原子的物质的量之比为
物质的量是表示含有一定数目微粒集合体的物理量。下列说法错误的是( )
A . 该物理量不能用于描述宏观物质形成的集合体
B . 1 mol某种微粒集合体含微粒数目约为6.02×1023
C . 1 mol N2的质量为28 g
D . 化学反应中各物质的质量之比等于它们的物质的量之比
某醇和醛的混合物0.05 mol,能从足量的银氨溶液中还原出16.2 g银,已知该醇为饱和一元醇,该醛的组成符合通式CnH2nO,下列结论正确的是 ( )
A . 此混合物中的醛一定不是甲醛
B . 此混合物中的醇、醛的物质的量之比是1∶3
C . 此混合物中的醛、醇可以是任意比
D . 此混合物中的醇、醛的物质的量之比是1∶1
NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A . 60gSiO2晶体中含有的Si—O键数目为2NA
B . pH=1的H3PO4溶液中所含H+的数目为0.1NA
C . 用含0.1molFeCl3的饱和溶液制备Fe(OH)3胶体,所得胶体粒子数目最多为0.1NA
D . 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,Na失去NA个电子
将5.6 g Fe全部溶于200 mL一定浓度的硝酸溶液中,得到标准状况下的气体2.24 L(该气体可能为NO或NO2或NO和NO2的混合气体),又测得反应后溶液中H+的物质的量浓度为0.2 mol·L-1(设反应前后溶液体积的变化忽略不计)。下列说法正确的是( )
A . 2.24 L气体是NO和NO2的混合气体
B . 反应后的溶液中含有Fe2+和Fe3+
C . 反应后的溶液中c( 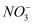 )=1.5 mol·L-1
D . 反应后的溶液最多还能再溶解3.64 g Fe
)=1.5 mol·L-1
D . 反应后的溶液最多还能再溶解3.64 g Fe
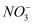 )=1.5 mol·L-1
D . 反应后的溶液最多还能再溶解3.64 g Fe
)=1.5 mol·L-1
D . 反应后的溶液最多还能再溶解3.64 g Fe
按要求完成下列各小题。
-
(1) 若1mL水为20滴,则1滴水约有个水分子(保留2位有效数字)。
-
(2) 已知每100g乳酸中含碳元素40.00g,含氢元素6.67g,其余都是氧元素,则乳酸分子中N(C):N(H):N(O)=(最简整数比)
-
(3) 实验室使用的浓盐酸的溶质质量分数为36.5%,密度为1.19g·cm-3 , 则该浓盐酸的物质的量浓度为。
-
(4) 实验室用高速离心机分离细胞各组分时需要使用蔗糖( C12H22O11)溶液,所需的蔗糖溶液的物质的量浓度为3.200 mol·L-1。含有137.0g蔗糖的该溶液的体积为。
-
(5) 汽车受到猛烈撞击时,气囊内的NaN3会发生分解反应生成Na和N2。能保护司机不受伤害的某气囊需要0.0672m3 (已折算到标准状况下)的N2 , 列式计算该气囊中需要装入NaN3的质量(写出计算过程)。
同温、同压下等质量的SO2气体和CO2气体,下列有关比较的叙述中,说法正确的是( )
①原子个数比为11:16
②分子个数比为11:16
③密度比为11:16
④体积比为16:11
A . ①②
B . ①④
C . ②③
D . ②④
将盛有60mLN2、NO2混合气体的试管倒立于水中,经过足够长的时间后,试管内气体的体积缩小为30mL,则原气体中N2、NO2的体积分别是( )
A . 15mL 45mI
B . 45mL 15ml
C . 20mL 40mL
D . 40ml 20ml
下列选项中正确的是( )
A . 标准状况下,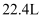 的
的 和
和 的混合气体中含有
的混合气体中含有 个原子
B . 物质的量浓度为
个原子
B . 物质的量浓度为 的
的 溶液中,含有的
溶液中,含有的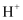 数为
数为 C . 稀盐酸与
C . 稀盐酸与 溶液混合,离子方程式为∶
溶液混合,离子方程式为∶ D . 少量铁粉与稀硝酸反应,离子方程式为∶
D . 少量铁粉与稀硝酸反应,离子方程式为∶
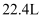 的
的 和
和 的混合气体中含有
的混合气体中含有 个原子
B . 物质的量浓度为
个原子
B . 物质的量浓度为 的
的 溶液中,含有的
溶液中,含有的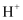 数为
数为 C . 稀盐酸与
C . 稀盐酸与 溶液混合,离子方程式为∶
溶液混合,离子方程式为∶ D . 少量铁粉与稀硝酸反应,离子方程式为∶
D . 少量铁粉与稀硝酸反应,离子方程式为∶
 表示阿伏加德罗常数的值。下列说法正确的是( )
表示阿伏加德罗常数的值。下列说法正确的是( )
A .  个
个 占有的体积为
占有的体积为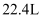 B . 标准状况下,
B . 标准状况下,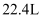
 含有的原子数目为
含有的原子数目为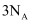 C . 常温常压下,
C . 常温常压下,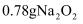 含有的离子数目为
含有的离子数目为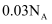 D . 物质的量浓度为
D . 物质的量浓度为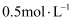 的
的 溶液中含有
溶液中含有 的数目为
的数目为
 个
个 占有的体积为
占有的体积为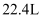 B . 标准状况下,
B . 标准状况下,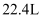
 含有的原子数目为
含有的原子数目为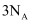 C . 常温常压下,
C . 常温常压下,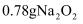 含有的离子数目为
含有的离子数目为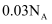 D . 物质的量浓度为
D . 物质的量浓度为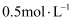 的
的 溶液中含有
溶液中含有 的数目为
的数目为
设NA表示阿伏加德罗常数值,下列说法中正确的是( )
A . 通常状况下,16g O2和O3混合气体所含的氧原子数为NA
B . 1mol/L的Na2SO4溶液中,含有的氧原子数为4NA
C . 标准状况下,22.4L H2O中含有的分子个数为NA
D . 标准状况下,22.4L空气所含气体的分子总数为NA
最近更新



