物质的量的相关计算 知识点题库
同温同压下,同体积的N2和SO2分子数之比为,原子总数之比为,质量之比为,密度之比为.
在20℃时,将4.95g KNO3溶于10.0g水中,恰好配成密度为1.15g/cm3的饱和溶液,计算
-
(1) 此饱和溶液中KNO3的物质的量.
-
(2) 此饱和溶液中KNO3的物质的量浓度.
下列各组物质中,所含分子数相同的是( )
A . 10g H2和10g O2
B . 5.6LCCl4(标准状况)和11gCO2
C . 9gH2O和0.5molBr2
D . 224mL H2(标准状况)和0.1molN2
根据题意填空:
-
(1) 已知16克A和20克B恰好完全反应生成0.05mol C和30克D,则C的摩尔质量为
-
(2) 0.3mol氨气和0.4mol二氧化碳的质量(填“相等”或“不相等”,下同),所含原子数.
-
(3) 4g H2与22.4L(标准状况)CO2相比,所含分子数目较多的是.
-
(4) 3.01×1023个CO2分子中含mol氧原子,在标准状况下其体积为L,它与g H2O含有相同的氧原子数.
-
(5) 写出下列物质的电离方程式:硫酸铵;氢氧化钡.
一种测定饮料中糖类物质的浓度(所有糖类物质以葡萄糖计算)的方法如下:取某无色饮料20.0 mL,经过处理,该饮料中糖类物质全部转化为葡萄糖,加入适量氢氧化钠溶液并稀释至100.0mL.取10.0mL稀释液,加入30.0mL0.01500mol·L-1I2溶液,充分反应后,再用0.0120mol·L-1Na2S2O3与剩余的I2反应,共消耗Na2S2O3溶液25.0mL。
已知:①I2在碱性条件下能与葡萄糖发生如下反应:C6H12O6+I2+3NaOH = C6H11O7Na+2NaI+2H2O
②Na2S2O3与I2能发生如下反应:I2+2Na2S2O3=2NaI+Na2S4O6
-
(1) 配制100mL0.01500mol·L-1I2溶液,需要准确称取gI2单质。(保留3位小数)
-
(2) 计算该饮料中糖类物质(均以葡萄糖计)的物质的量浓度。(请写出计算过程)
设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A . 常温时,12g石墨晶体中所含六元环数目为NA
B . 标准状况下,18g D2O中所含电子数为9 NA
C . 1mol N2与 4mol H2反应生成的NH3 分子数为2NA
D . 标准状况下,2.24L SO3中所含原子数为0.4 NA
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 标准状况下,11.2L乙醇完全燃烧生成CO2的分子数目为0.5NA
B . 1LpH=1的CH3COOH溶液中,H+的数目小于0.1NA
C . Na2O2和CO2反应后固体质量增加42g,转移的电子数目为1.5NA
D . 足量的Fe与71gCl2充分反应,转移的电子数目为3NA
在0.4L溶质由Na2SO4、Al2(SO4)3、CuSO4组成的混合溶液中,部分离了浓度大小如图所示。回答下列问题:

-
(1) 该混合液中,Al2(SO4)3的物质的量为mol,含CuSO4的质量为g。
-
(2) 该混合液中,Na2SO4的物质的量为mol,将该混合液加水稀释至体积为1L,稀释后溶液中Na+的物质的量浓度为mol·L-1。
-
(3) 向该溶液中加入足量的硝酸酸化的氯化钡溶液,可得到沉淀mol。
把6.5gZn放入足量的盐酸中,锌完全反应。计算:
-
(1) 6.5gZn的物质的量?。
-
(2) 参加反应的HCl的物质的量?。
-
(3) 生成氢气的体积(标准状况)?。
在标准状况下有:①6.72LCH4 , ②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3。下列对这四种气体的描述正确的是( )
A . 体积②>③>①>④
B . 密度②<③<④<①
C . 质量②>③>④>①
D . 氢原子个数①<③<④<②
设NA为阿伏加德罗常数的数值,下列说法错误的是( )
A . 46g NO2和N2O4的混合气体中,含有的氮原子数为1NA
B . 2.3gNa与O2完全反应,转移电子总数为0.1NA
C . 常温下,0.2mol/LNH4Cl溶液中,NH4+数目小于0.2NA
D . 1molSiO2晶体中,含有Si−O键的数目为4 NA
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 将1mol Cl2通入足量水中,溶液中HClO、Cl-、ClO-粒子数之和为2NA
B . 100g CaCO3晶体和100g KHSO4晶体中含有的离子数分别为2NA和3NA
C . 标准状况下,4.48L NO和2.24L O2混合后,原子总数为0.6NA
D . 已知3BrF3 + 5H2O=HBrO3 + Br2 + 9HF + O2↑,若有5mol H2O参加反应,则被水还原的BrF3分子数目为3NA
Cl2与NaOH溶液反应可生成NaCl、NaClO和NaClO3(Cl-和ClO-)的比值与反应的温度有关,用24gNaOH配成的250mL溶液,与Cl2恰好完全反应(忽略Cl2与水的反应、盐类的水解及溶液体积变化):
-
(1) NaOH溶液的物质的量浓度mol·L-1;
-
(2) 某温度下,反应后溶液中c(Cl-)=6c(ClO-),则溶液中c(ClO-) =mol·L-1。
设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A . 0.5molO3与11.2LO2所含的分子数一定相等
B . 常温常压下,18gH2O中含有的原子总数为3NA
C . 0.5mol•L-1的K2SO4溶液中含有的钾离子数目为NA
D . 常温常压下,22.4L的NO2和CO2混合气体含有2NA个氧原子
将一定质量Na2CO3和NaHCO3的均匀混合物分成等量的两份。将其中的一份直接加热至恒重,质量减轻了1.24 g;另一份加入一定量某浓度的盐酸至恰好反应完全,收集到标准状况下2.24 L 气体,消耗盐酸40.0
mL。试计算:
-
(1) 原均匀混合物中NaHCO3的物质的量n(NaHCO3)= mol;
-
(2) 盐酸的浓度c(HCl)= mol·L-1。
 表示阿伏加德罗常数,下列说法正确的是( )
表示阿伏加德罗常数,下列说法正确的是( )
A .  溶液中,含有Cl-个数为
溶液中,含有Cl-个数为  B . 浓盐酸与
B . 浓盐酸与  共热产生
共热产生 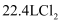 时,转移电子数为
时,转移电子数为 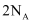 C . 室温下,
C . 室温下, 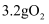 和
和 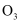 的混合气体中含有的氧原子数为
的混合气体中含有的氧原子数为  D . 标准状况下体积均为
D . 标准状况下体积均为 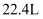 的
的  和氦气,均含有
和氦气,均含有 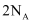 个原子
个原子
 溶液中,含有Cl-个数为
溶液中,含有Cl-个数为  B . 浓盐酸与
B . 浓盐酸与  共热产生
共热产生 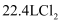 时,转移电子数为
时,转移电子数为 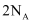 C . 室温下,
C . 室温下, 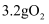 和
和 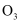 的混合气体中含有的氧原子数为
的混合气体中含有的氧原子数为  D . 标准状况下体积均为
D . 标准状况下体积均为 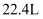 的
的  和氦气,均含有
和氦气,均含有 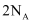 个原子
个原子
为了测定某铜银合金的组成,将30.0g合金溶于80 ml 13.5 mol/L 的浓HNO3中待合金完全溶解后,收集到气体6.72 L(标准状况,不考虑四氧化二氮),并测得溶液的H+浓度为1mol/L,假设反应后溶液的体积仍为80m L,试计算:
-
(1) 被还原的硝酸的物质的量mol;
-
(2) 在反应后的混合溶液中加入mol氢氧化钠使沉淀的质量达到最大。
-
(1) 0.5L1.0molL-1FeCl3溶液与0.2L1.0molL-1MgCl2溶液中的Cl-的物质的量浓度之比为。
-
(2) 某气体的质量为3.4g,含有6.02×1022个分子,则该气体的摩尔质量为。
-
(3) 配制90mL0.1mol/LCuSO4溶液,需要胆矾g。
-
(4) 氧化还原反应S+KOH→K2S+K2SO3+H2O(未配平)中,氧化剂与还原剂的物质的量之比为,若反应中消耗了0.6molS,则反应中转移的电子为mol。
-
(5) 某元素R的简单阴离子Rn-核外有a个电子,中子数为b,则其质量数为。
在25℃时用铜作电极电解饱和Na2SO4溶液,过一段时间后,阴极产生a mol气体,同时有W g Na2SO4·10H2O晶体析出。若电解过程中始终保持温度不变,则原Na2SO4溶液的质量分数浓度为( )
A . 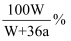 B .
B . 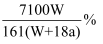 C .
C .  D .
D . 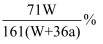
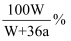 B .
B . 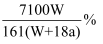 C .
C .  D .
D . 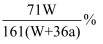
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 2.24 L CH4与1.8 g H2O所含电子数均为NA
B . 1 mol SO2与3 mol O2充分混合反应后,转移的电子数为2NA
C . 14 g N2和CO的混合气体中含有的氧原子数为0.5NA
D . 17 g液氨中含有的共价键数是3NA
最近更新



