物质的量的相关计算 知识点题库
在标准状况下,O2与H2的密度之比为( )
A . 4:1
B . 8:1
C . 32:1
D . 16:1
下列情况下,气体分子数相同的是( )
A . 标准状况下,71gCl2和22.4LHCl
B . 相同质量的氢气和氮气
C . 在0℃时,1体积的O2和1体积的HCl
D . 相同体积的CO2和 H2O
根据计算填空
-
(1) 某物质含有3.01×1022个分子,其质量为1.4g,则物质的相对分子质量为.若只含有一种元素,则分子式为:.
-
(2) 某物质的相对分子质量为98,若19.6g该物质含有1.204×1023个分子,则阿伏加德罗常数为.若agCO32﹣分子中含有b个电子,则阿伏加德罗常数可表示为.
22g CO2所含的分子数为个,所含原子个数与标准状况下 LCH4所含原子个数相同.
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A . 1L0.1 mol•L﹣1的氨水中含有0.1NA个OH﹣
B . 78gNa2O2固体中含有的阴离子数目为2NA
C . 常温下,23gNO2和N2O4的混合气体含有NA个氧原子
D . 常温下,4gCH4中含有4NA个C﹣H共价键
下列叙述正确的是( )
A . 标准状况下,22.4L CO所含原子的物质的量为1mol
B . 33.6LNH3气体所含分子的物质的量为1.5mol
C . 同温同压下,相同体积的物质,其物质的量一定相等
D . 同温同压下,一氧化碳气体和氮气,若体积相等,则质量一定相等
-
(1) 6.8克NH3的物质的量为mol,含质子的物质的量为mol,该气体在标准状况下的体积为L.
-
(2) 4.8gO3和0.2molCH4 , 质量之比是,在同温同压下的体积之比是.相同质量的O2和SO2 , 所含分子的数目之比为,所含O 原子的物质的量之比为。
向含H2S、Fe2+、Br-、I-各0.1 mol的溶液中通入Cl2 , 通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
设NA为阿伏加德罗常数的值,下列叙述中错误的是( )
A . 1mol乙烯分子中含有的σ键数为5NA
B . 1mol甲烷完全燃烧转移的电子数为8NA
C . 标准状况下,22.4 L甲苯中含有H原子数大于8NA
D . 将苯、溴水、溴化铁混合置于一洁净的试管中,可以制备溴苯
阿伏加德罗常数的值为NA。下列说法正确的是( )
A . 1 L 0.1 mol·L-1 NH4Cl溶液中,NH4+的数量为0.1NA
B . 2.4 g Mg与H2SO4完全反应,转移的电子数为0.1NA
C . 标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
D . 0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2NA
浓度均为1 mol/L KCl、CuCl2、AlCl3三种溶液,分别与AgNO3溶液反应,当生成的AgCl沉淀的质量之比为3︰2︰1时,所用KCl、CuCl2、AlCl3三种溶液的体积比为( )
A . 9︰6︰2
B . 9︰3︰1
C . 6︰3︰2
D . 6︰3︰1
-
(1) 顺铂(化学名称为顺二氯二氨合铂(II),化学式为PtCl2(NH3)2 , 相对分子质量为:300)是一种用于治疗癌症的药物,一片顺铂药片所含顺铂的质量为6×10-4g,那么一片顺铂药片中N原子的物质的量mol;
-
(2) 乙烯气体(C2H4)是石油化工产品之一,也是最重要的有机化工基础原料之一,在标准状况下其密度为g•L-1;
-
(3) 现有一种矿泉水样品,1.0L的该矿泉水含有4.8×10-2gMg2+ , 则L矿泉水中含有1mol Mg2+;
-
(4) 某“84消毒液”1000mL,其有效成分为NaClO(式量:74.5),质量分数为14.9%,密度为1.2g/mL,其溶质的物质的量浓度为mol•L﹣1;
-
(5) 已知CO和CO2的混合气体7.2g,在标准状况下所占的体积为4.48L。则该混合气体中氧元素的质量为g;
将标准状况下的a L NH3完全溶于1 L水,得到体积为V L、密度为b g•cm-3(b<1)、物质的量浓度为c mol•L-1、溶质质量分数为w的氨水(溶质按NH3算 ),下列叙述中错误的是( )
A . c =  B . w=
B . w=  ×100%
C . 若将该氨水蒸发出部分水(不考虑溶质NH3的逸出),使溶液质量变为原来一半,则浓度大于2c
D . 上述溶液中再加入V L水 ,所得溶液的质量分数小于0.5w
×100%
C . 若将该氨水蒸发出部分水(不考虑溶质NH3的逸出),使溶液质量变为原来一半,则浓度大于2c
D . 上述溶液中再加入V L水 ,所得溶液的质量分数小于0.5w
 B . w=
B . w=  ×100%
C . 若将该氨水蒸发出部分水(不考虑溶质NH3的逸出),使溶液质量变为原来一半,则浓度大于2c
D . 上述溶液中再加入V L水 ,所得溶液的质量分数小于0.5w
×100%
C . 若将该氨水蒸发出部分水(不考虑溶质NH3的逸出),使溶液质量变为原来一半,则浓度大于2c
D . 上述溶液中再加入V L水 ,所得溶液的质量分数小于0.5w
相同状况下,下列气体所占体积最大的是( )
A . 80g SO3
B . 16g O2
C . 3g H2
D . 32g H2S
NA为阿伏加德罗常数的值。下列说法正确的是( )
A . 硝酸与铜反应得到NO2、N2O4共46g,则铜失去的电子数为NA
B . 常温下,pH=5的CH3COOH溶液中,水电离出的H+数为10-9 NA
C . 1.0 mol 乙酸与足量的乙醇充分反应生成的H2O分子数为1.0NA
D . 60g二氧化硅晶体中含硅氧键的数目为2NA
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 2L0.5mol/LCH3COOH溶液中含有H+的数目为NA
B . 23gNa与足量H2O反应完全后生成H2的体积为11.2L
C . 密闭容器中2molSO2与1molO2充分反应,产物的分子数为2NA
D . 物质的量相同的  和CH3CHO所含共价键数目相同
和CH3CHO所含共价键数目相同
NA表示阿伏加德罗常数,下列说法中正确的是( )
A . 标准状况下,11.2L水含有的分子数为0.5NA
B . 120gNaHSO4和KHSO3的固体混合物中含有的阳离子数为NA
C . 5.6gFe与足量稀硫酸完全反应时失电子数是0.3NA
D . 0.1mol/L的氯化镁溶液中,含有Cl-的数目为0.2NA
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A . 11.2LCO所含原子数为NA
B . 1molNO2溶于水时,转移电子数为2NA
C . 常温常压下,1.6gO2和O3的混合气体中含有的氧原子数为0.1NA
D . 100mL1mol/LHNO3溶液中含有的离子数为0.1NA
已知A为生活中常见的金属单质,下列物质相互转化如图所示:

试回答:
-
(1) 写出A的化学式,D的化学式。
-
(2) 向G溶液加入A的有关离子反应方程式。
-
(3) 在反应Fe2O3+3CO
 2Fe+3CO2中,还原剂是(填化学式,下同),还原产物是,每生成5.6g铁单质,转移的电子数为NA。
2Fe+3CO2中,还原剂是(填化学式,下同),还原产物是,每生成5.6g铁单质,转移的电子数为NA。
-
(4) FeSO4在高温条件下会分解得到一种红色固体和两种含硫气体,试从氧化还原反应的角度分析并写出该反应的方程式。
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和 的混合气体,这些气体与
的混合气体,这些气体与 (标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入
(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入 溶液至
溶液至 恰好完全沉淀,则消耗
恰好完全沉淀,则消耗 溶液的体积是( )
溶液的体积是( )
 的混合气体,这些气体与
的混合气体,这些气体与 (标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入
(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入 溶液至
溶液至 恰好完全沉淀,则消耗
恰好完全沉淀,则消耗 溶液的体积是( )
溶液的体积是( )
A .  B .
B .  C .
C . 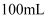 D .
D . 
 B .
B .  C .
C . 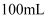 D .
D . 
最近更新



