物质的量的相关计算 知识点题库
在下列各组物质中,分子数相同的是( )
A . 2LCO和2LCO2
B . 9g H2O和标准状况下11.2LCO2
C . 标准状况下1molO2和22.4LH2O
D . 0.2molH2和22.4LHCl气体
利用“化学计量在实验中的应用”的相关知识填空.
-
(1) 含有6.02×1023个氧原子的H2SO4的物质的量是.
-
(2) 与标准状况下V LCO2所含氧原子数目相同的水的质量是 g(用分式表示)
-
(3) 将4g NaOH溶解在10mL水中,再稀释成1L,从中取出10mL,这10mL溶液的物质的量浓度为.
-
(4) 在一定的温度和压强下,1体积X2(g)跟3体积Y2(g)化合生成2体积化合物,则该化合物的化学式是.
-
(5) 将50mL 0.1mol•L﹣1 NaCl和50mL 0.5mol•L﹣1 CaCl2 溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c(Cl ﹣)为.
-
(6) 三种正盐的混合溶液中含有0.2mol Na+、0.25mol Mg2+、0.4mol Cl﹣和SO42﹣ , 则n(SO42﹣)为.
下列说法中正确的是( )
A . O2的摩尔质量是32g
B . 氯化钠的相对原子质量是58.5g
C . 1molH2O的质量是18g
D . 1molH2O含有氢原子的个数2个
下列有关1mol O2的说法中,不正确的是(NA表示阿伏加德罗常数)( )
A . 质量为32g
B . 含氧原子数为NA
C . 含氧分子数为NA
D . 在标准状况下,体积约为22.4L
下列物质中所含分子物质的量最多的是( )
A . 56g N2
B . 1.5mol O2
C . 标准状态下22.4L Cl2
D . 3.01×1023个硫酸分子
-
(1) 0.7 mol H2O的质量为。
-
(2) 质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是。
-
(3) 20mL0.1mol/LBaCl2溶液中Ba2+的物质的量是。
-
(4) 含0.4 mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是。
-
(5) 12.4 g Na2R含Na+0.4 mol,则R的相对原子质量为。
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A . 含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B . 在常温常压下,11.2L Cl2含有的分子数为0.5NA
C . 25℃,1.01×105Pa,64gSO2中含有的原子数为3NA
D . 标准状况下,11.2LH2O含有的分子数为0.5NA
用NA表示阿伏加德罗常数。下列叙述正确的是( )
A . 标准状况下,22.4LH2O含有的分子数为NA
B . 常温常压下,1.06gNa2CO3含有的Na+数为0.02NA
C . 通常状况下,NA个CO2分子占有的体积为22.4L
D . 物质的量浓度为0.5mol·L-1的MgCl2溶液中,含有Cl-数为NA
某强酸性溶液X可能含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣一种或几种,取该溶液进行连续实验,实验过程如下:根据以上信息,回答下列问题:

-
(1) 仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是。为证明该阴离子是否存在,需要加入试剂(写化学式)。
-
(2) 用离子方程表达下列反应:
①中生成气体A:。
②中生成溶液H:。
-
(3) 若②中所用氢氧化钠浓度为2mol/L,当加入l0ml时开始产生沉淀,55ml时沉淀的量达到最大值0.03mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025mol且保持不变,则原溶液中c(Fe2+)为mol/L、c(Cl﹣)为mol/L。(若离子不存在,请填0mol/L)
NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为 0.1 NA
B . 1 L 0.1 mol/L的 H2SO4溶液中氧原子的总数大于 0.4 NA
C . 58.5 g氯化钠晶体中含有 NA个氯化钠分子
D . 120 g NaHSO4晶体中阳离子和阴离子的总数为 3 NA
设NA表示阿伏加德罗常数的值。回答下列问题:
-
(1) 0.3mol NH3分子中所含原子数与个H2O分子中所含原子数相等。
-
(2) 含0.4mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是
-
(3) —定条件下,16g A和20g B恰好完全反应生成0.04mol C和31.76g D,则C的摩尔质量为
-
(4) 某混合盐溶液中含有离子:Na+、Mg2+、Cl-、SO42-,测得Na+、Mg2+和Cl-的物质的量浓度依次为: 0.2mol·L-1、0.25mol·L-1、0.4mol·L-1,则c(SO42-) =。
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A . 0.2mol丁烷完全裂解生成乙烯的分子数一定为0.2NA
B . 13gNaN3爆炸分解为Na和N2 , 转移电子数为0.2NA
C . 1L0.1mol·L-1(NH4)2SO3溶液中,含NH4+数目为0.2NA
D . 0.2molN2O4充入密闭容器中,产生气体分子总数为0.4NA
NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 某温度下,pH=6的纯水中所含有的OH-的数目为1.0×10-6NA
B . 7.8 g Na2O2固体中含有的阴阳离子总数为0.4NA
C . 标准状况下,5.6L的甲醛气体中含有的质子数目为4NA
D . 1 L浓度为0.100mol·L−1的NaHCO3溶液中,阴离子数为0.100NA
常温下,2 L 0.5 mol·L-1的K2SO4溶液含有( )
A . 0.5 mol K+
B . 1.0 mol K+
C . 1.0 mol S2-
D . 1.0 mol SO 

2020年初,突如其来的新型冠状肺炎在全世界肆虐,依据研究,含氯消毒剂可以有效灭活新冠病毒,为阻断疫情做出了巨大贡献。二氧化氯(ClO2)就是其中一种高效消毒灭菌剂,但其稳定性较差,可转化为较稳定的NaClO2保存。工业上常用吸收法和电解法制备NaClO2 , 其工艺流程示意图如图1。


已知:a.纯ClO2熔点为-59℃,沸点为11℃ ,纯的ClO2受热或遇光易发生爆炸,一般稀释到10%以下。
b.长期放置或高于60℃时,NaClO2易分解生成NaClO3和NaCl。
-
(1) 步骤1中,生成ClO2的化学方程式是,通入空气的作用是 。
-
(2) 方法1中,反应的离子方程式是,利用方法1制NaClO2时,温度不能超过35℃,可能的原因是 。
-
(3) 方法2中,NaClO2在生成(选填“阴极”或“阳极”)。
-
(4) NaClO2的溶解度曲线如图2所示,步骤3从NaClO2溶液中获得NaClO2的操作是:加热温度至略低于60℃、、,过滤、洗涤、干燥。
-
(5) 保存液态ClO2的条件是(填字母)。
a.常温、密封、不避光 b.低温、密封、避光 c.常温、敞口、避光 d.低温、敞口、不避光
-
(6) ClO2 在杀菌的同时,可将剧毒氰化物氧化成无毒气体,ClO2 被还原为Cl-。某工厂污水中含CN- a mg/L,处理10m3这种污水,至少需要ClO2 mol。
-
(1) Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:

已知NaHCO3在低温下溶解度较小。
反应Ⅰ的化学方程式为。
-
(2) 处理母液的方法:向母液中加入石灰乳,反应的化学方程式为,目的是使循环利用。
-
(3) Ⅱ.某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3 , 然后再将NaHCO3制成Na2CO3。
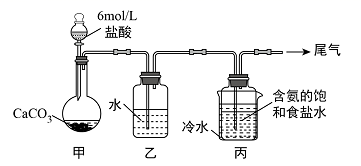
装置丙中冷水的作用是;由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有、洗涤、灼烧。
-
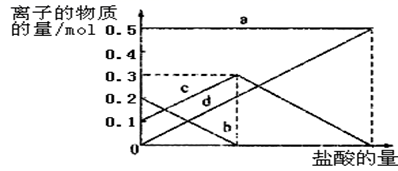
(4) 若灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1min的NaHCO3样品的组成进行了以下探究。取加热了t1min的NaHCO3样品29.6g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。曲线c对应的溶液中的离子是(填离子符号);该样品中NaHCO3和Na2CO3的物质的量分别是mol、mol。
以天然气为原料经由合成气(CO、H2)制化学品是目前天然气转化利用的主导技术路线。制备CH3OH的反应转化关系如图所示。设NA为阿伏加德罗常数的值,下列说法正确的是( )
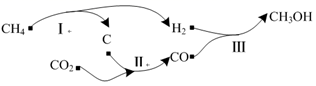
A . 用1 mol CH4理论上能生产标准状况下CH3OH 22.4 L
B . 等物质的量的CH3OH和CH4 , CH3OH的质子数比CH4多8NA
C . 44 g CO2气体和44 g CH4与CO的混合气体,所含C原子数均为NA
D . 用CH4制备合成气的反应中,若生成1 mol CO,反应转移电子数为3NA
下列说法正确的是( )
A . CO2的摩尔质量是44g
B . CO2的摩尔质量与CO2的相对分子质量在数值上相等
C . CO2的摩尔质量等于CO2的相对分子质量
D . 1molCO2的质量为44g/mol
将钠、铝混合物投入足量水(质量为100g)中进行反应,若钠、铝的质量分别为46g和27g,充分反应后,下列说法正确的是( )
A . 产生 的物质的量为2.5mol
B . 溶液中的溶质只有
的物质的量为2.5mol
B . 溶液中的溶质只有 C . 金属未完全溶解
D .
C . 金属未完全溶解
D .  的质量分数是
的质量分数是
 的物质的量为2.5mol
B . 溶液中的溶质只有
的物质的量为2.5mol
B . 溶液中的溶质只有 C . 金属未完全溶解
D .
C . 金属未完全溶解
D .  的质量分数是
的质量分数是
用NaCl固体配制100mL 1.00mol/L NaCl溶液,回答下列问题。
-
(1) 需要的仪器有(填序号)。
a.
 b.
b. c.
c. d.
d.
-
(2) 计算需要NaCl固体的质量是克。
-
(3) 量取配好的溶液25mL,加入20mLAgNO3溶液时,恰好沉淀完全,则
 mol/L。
mol/L。
-
(4) 如果配制溶液过程中未洗涤溶解NaCl固体的烧杯,则最后配成的溶液中NaCl的浓度比所要求的(填“偏高”、“偏低”或“无影响”),理由是。
最近更新



