氧化还原反应的电子转移数目计算 知识点题库
水热法制备Fe3O4纳米颗粒的反应为3Fe2+ +2S2O32-+O2 +xOH-=Fe3O4+S4O62-+2H2O,下列说法中不正确的是( )
A . 每生成1mol Fe3O4 , 反应转移的电子总数为4mol
B . Fe2+和S2O32-都是还原剂
C . 1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol
D . x=4
黄铁矿(主要成分为FeS2)的有效利用对环境具有重要意义。
-
(1) 在酸性条件下催化氧化黄铁矿的物质转化关系如图1所示。
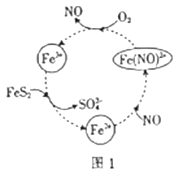
①图1转化过程的总反应中,FeS2作(填“催化剂”“氧化剂” 或“还原剂”,下同)。该转化过程中NO的作用是。
②写出图1中Fe3+与FeS2反应的离子方程式:。
-
(2) FeS2 氧化为Fe3+的过程中,控制起始时Fe2+的浓度、溶液体积和通入O2的速率不变,改变其他条件时,Fe2+被氧化的转化率随时间的变化如图2 所示。
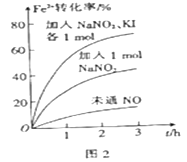
①加入NaNO2 发生反应:2H++3NO2-=NO3-+2NO↑+H2O。该反应中若有6 mol NaNO2完全反应,转移电子的物质的量为mol。
②加入NaNO2、KI 发生反应:4H++2NO2-+2I-=2NO↑+I2+2H2O。解释图2中该条件下能进一步提高单位时间内Fe2+转化率的原因:。
工业上冶炼锡的第一步反应原理为2SnO2 + 3C= 2Sn + aM↑+ CO2↑,则下列说法中错误的是( )
A . 反应中SnO2被还原
B . a的值为3
C . 反应后有两种氧化产物
D . 每生成1 mol CO2转移电子8 mol
NA为阿伏加德罗常数的值,下列说法正确的是()
A . 1molSiO2晶体中,含有Si−O键的数目为2NA
B . 16.8g铁粉与足量高温水蒸气反应,转移电子数为0.8NA
C . 1mol·L−AlCl3溶液中,含有Cl−的数目为3NA
D . 18gD2O和H2O的混合物中,含有的中子数为9NA
-
(1) I、KClO3和浓盐酸在一定温度下反应,还原产物为黄绿色的易爆物二氧化氯。其变化可以表示为:□KClO3+□HCl(浓)→□KCl+□ClO2↑+□Cl2↑+□H2O+□_
请配平该化学方程式。
-
(2) 浓盐酸在反应中显示出来的性质是(填编号)。
①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性
-
(3) Ⅱ、已知反应:2H2CrO4+3H2O2=2Cr(OH)3↑+2H2O该反应中H2O2只发生如下变化过程H2O2→H2O
①该反应中的还原剂是。
②该反应中被还原的元素是,还原产物是。
③若产生的气体在标准状况下体积为3.36L,则反应中转移了mol电子
已知黑火药爆炸的反应:S+2KNO3+3C → K2S+3CO2+ N2↑,下列说法正确的是( )
A . 该反应中氧化剂只有硝酸钾
B . 该反应中还原剂只有碳
C . 每生成0.1 mol N2转移电子1 mol
D . 产物中有两种共价化合物
NA表示阿伏加德罗常数的值,下列说法中错误的是( )
A . 标准状况下22.4 L异丁烷的分子数为NA
B . 78 g苯(C6H6)和苯乙烯(C8H8)的混合物中含有的碳氢键数一定为6NA
C . 某温度下,1L pH=3的醋酸溶液稀释到10L时,溶液中H+的数目大于0.01NA
D . 向仅含0.2 mol FeI2的溶液中持续通入Cl2 , 当有0.1 mol Fe2+被氧化时,转移电子的数目为0.5NA 。(不考虑Cl2与H2O的反应)
FeS与一定浓度的HNO3溶液反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O。当NO2、N2O4、NO的物质的量之比为1:1:1时,参加反应的FeS与HNO3的物质的量之比为( )
A . 1:6
B . 1:7
C . 2:11
D . 16:5
某温度下将  通入
通入  溶液里,反应后得到
溶液里,反应后得到 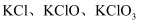 的混合溶液,经测定
的混合溶液,经测定 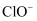 与
与  的物质的量之比为11:1,则
的物质的量之比为11:1,则 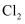 与
与 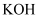 反应时,被还原的氯元素和被氧化的氯元素的质量之比为( )
反应时,被还原的氯元素和被氧化的氯元素的质量之比为( )
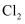 通入
通入 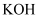 溶液里,反应后得到
溶液里,反应后得到 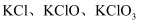 的混合溶液,经测定
的混合溶液,经测定 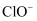 与
与  的物质的量之比为11:1,则
的物质的量之比为11:1,则 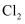 与
与 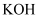 反应时,被还原的氯元素和被氧化的氯元素的质量之比为( )
反应时,被还原的氯元素和被氧化的氯元素的质量之比为( )
A . 1:3
B . 4:3
C . 2:1
D . 3:1
工业上制备TiCl,的反应:TiO2+2Cl2+2C  TiCl4+2CO下列有关该反应的说法正确的是( )
TiCl4+2CO下列有关该反应的说法正确的是( )
 TiCl4+2CO下列有关该反应的说法正确的是( )
TiCl4+2CO下列有关该反应的说法正确的是( )
A . TiO2是氧化剂
B . Cl2发生还原反应
C . C元素被还原
D . 生成1molTiCl4时转移2mol电子
食盐中的碘以碘酸钾  形式存在,可根据反应
形式存在,可根据反应  ,验证食盐中存在
,验证食盐中存在  。根据上述反应,下列说法正确的是( )
。根据上述反应,下列说法正确的是( )
 形式存在,可根据反应
形式存在,可根据反应  ,验证食盐中存在
,验证食盐中存在  。根据上述反应,下列说法正确的是( )
。根据上述反应,下列说法正确的是( )
A . 由  知,
知, 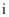 是第ⅤA族元素
B .
是第ⅤA族元素
B .  是氧化产物,
是氧化产物, 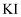 是还原产物
C . 对应的离子方程式为
是还原产物
C . 对应的离子方程式为  D . 每生成
D . 每生成  ,转移电子的物质的量为
,转移电子的物质的量为 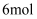
 知,
知,  是第ⅤA族元素
B .
是第ⅤA族元素
B .  是氧化产物,
是氧化产物, 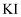 是还原产物
C . 对应的离子方程式为
是还原产物
C . 对应的离子方程式为  D . 每生成
D . 每生成  ,转移电子的物质的量为
,转移电子的物质的量为 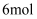
羟基自由基(·OH)是自然界中氧化性仅次于氟的氧化剂。一种能将苯酚(C6H5OH)氧化为CO2、H2O的原电池-电解池组合装置如图。该装置能实现发电、环保二位一体。下列说法错误的是( )
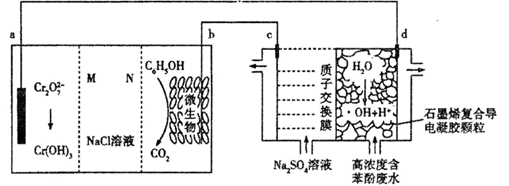
A . c极为阴极,M为阳离子交换膜
B . b极的电极反应式为C6H5OH-28e-+28OH-=6CO2↑+17H2O
C . d极区苯酚被氧化的反应为C6H5OH+28·OH=6CO2↑+17H2O
D . 右侧装置中,每转移0.7 mol e- , c、d两极共产生气体11.2L(标准状况)
洁厕灵和84消毒液混合使用会发生反应: 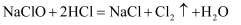 ,生成有毒的氯气。NA代表阿伏加德罗常数的值,下列说法正确的是( )
,生成有毒的氯气。NA代表阿伏加德罗常数的值,下列说法正确的是( )
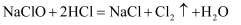 ,生成有毒的氯气。NA代表阿伏加德罗常数的值,下列说法正确的是( )
,生成有毒的氯气。NA代表阿伏加德罗常数的值,下列说法正确的是( )
A . 每生成  氯气,转移的电子数为2NA
B .
氯气,转移的电子数为2NA
B . 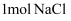 含有的电子数为28NA
C .
含有的电子数为28NA
C . 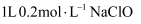 溶液中含有的次氯酸根离子数为0.2NA
D . 将分子总数为NA的
溶液中含有的次氯酸根离子数为0.2NA
D . 将分子总数为NA的  和
和  的混合气体置于标准状况下,其体积约为
的混合气体置于标准状况下,其体积约为 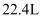
 氯气,转移的电子数为2NA
B .
氯气,转移的电子数为2NA
B . 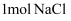 含有的电子数为28NA
C .
含有的电子数为28NA
C . 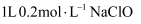 溶液中含有的次氯酸根离子数为0.2NA
D . 将分子总数为NA的
溶液中含有的次氯酸根离子数为0.2NA
D . 将分子总数为NA的  和
和  的混合气体置于标准状况下,其体积约为
的混合气体置于标准状况下,其体积约为 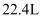
设NA为阿伏加德罗常数的值。下列说法错误的是( )
A . 常温常压下,1.0molFe和足量浓硝酸混合反应,转移电子数为3NA
B . 等质量的乙烯和丙烯中含有的共用电子对数相等
C . 常温下,1.0LpH=13的Ba(OH)2溶液中含OH-的数目为0.1NA
D . 0.1mol的11B中,含有0.6NA个中子
硼氢化钠(NaBH4)是有机反应中常用强还原剂,其在催化剂作用下与水反应获得氢气的微观过程如图所示。下列说法错误的是( )
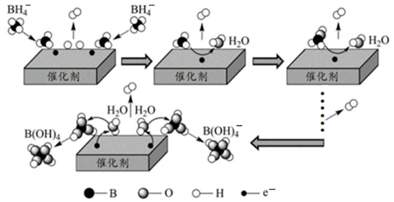
A . BH  、BH3、B(OH)
、BH3、B(OH)  中B的杂化方式有两种
B . 整个过程中出现了6种含硼微粒
C . NaBH4中含有离子键、共价键、配位键
D . 每产生1molH2转移2mol电子
中B的杂化方式有两种
B . 整个过程中出现了6种含硼微粒
C . NaBH4中含有离子键、共价键、配位键
D . 每产生1molH2转移2mol电子
 、BH3、B(OH)
、BH3、B(OH)  中B的杂化方式有两种
B . 整个过程中出现了6种含硼微粒
C . NaBH4中含有离子键、共价键、配位键
D . 每产生1molH2转移2mol电子
中B的杂化方式有两种
B . 整个过程中出现了6种含硼微粒
C . NaBH4中含有离子键、共价键、配位键
D . 每产生1molH2转移2mol电子
-
(1) 根据要求填空
①画出硫原子和镁离子的结构示意图: 、。
②过氧化钠的化学式:。
③写出CH3COOH的电离方程式:。
④用双线桥表示出反应中电子转移的方向和数目SiO2+2C+2Cl2
 SiCl4+2CO。
SiCl4+2CO。 -
(2) 标准状况下,同体积NH3与H2S气体的质量比为,所含氢原子个数比为;同温同压下,同质量NH3和H2S的体积比为,所含氢原子个数比为。
在酸性条件下可发生反应:SO  +2MO
+2MO 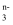 +2H+=2MO2+SO
+2H+=2MO2+SO  +H2O,MO
+H2O,MO 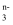 中 M 的化合价是( )
中 M 的化合价是( )
 +2MO
+2MO 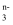 +2H+=2MO2+SO
+2H+=2MO2+SO  +H2O,MO
+H2O,MO 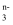 中 M 的化合价是( )
中 M 的化合价是( )
A . +7
B . +6
C . +5
D . +4
SO2在生产生活中具有重要的作用,利用分类法和氧化还原反应等知识可以对它有较理性的认识。
-
(1) SO2属于(填“酸性氧化物”或“碱性氧化物”),可预知其能与碱反应。
-
(2) SO2能否与浓硫酸发生氧化还原反应?(填“能”或“否”),理由是:,能否与 HNO3 溶液发生氧化还原反应?(填“能”或“否”),理由是 。
-
(3) 向锌粉的悬浊液中通入二氧化硫可制备一种含+3 价硫的盐 ZnS2O4 , 这体现了SO2的 性,反应的化学方程式为,若反应中有0.1NA个电子转移,则有 gZnS2O4 生成。
钨是熔点最高的金属,广泛用于生产、生活中,如用钨丝作灯丝等。工业上以白钨矿(主要成分为CaWO4)为原料冶炼钨的工艺流程如下:
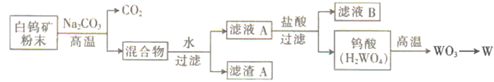
已知:H2WO4难溶于水。
回答下列问题:
-
(1) 白钨矿粉末与碳酸钠在800~900℃条件下发生反应:CaWO4+Na2CO3
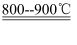 CaO+Na2WO4+CO2↑。该反应(填“是”或“不是”)氧化还原反应,WO3是(填“酸性”或“碱性”)氧化物。
CaO+Na2WO4+CO2↑。该反应(填“是”或“不是”)氧化还原反应,WO3是(填“酸性”或“碱性”)氧化物。
-
(2) 滤液A中Na2WO4与盐酸反应的离子方程式为。
-
(3) 一氧化碳、铝、氢气都可以还原WO3冶炼W。
①欲制备等质量的钨,需作还原剂的CO、Al、H2的物质的量之比为。
②写出氢气在加热条件下与WO3发生置换反应的化学方程式并用单线桥法标出电子转移的方向和数目:。
中国科学院科研团队研究发现,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图如下。下列说法错误的是( )
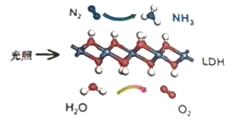
A . 该过程将太阳能转化成为化学能
B . 该过程中,只涉及到极性键的断裂与生成
C . 氧化剂与还原剂的物质的量之比为1:3
D . 原料气N2可通过分离液态空气获得
最近更新



