еёёи§ҒйҮ‘еұһзҡ„жҙ»еҠЁжҖ§йЎәеәҸеҸҠе…¶еә”з”Ё зҹҘиҜҶзӮ№йўҳеә“
в‘ ең°еЈідёӯзҡ„йҮ‘еұһе…ғзҙ зҡ„еҗ«йҮҸпјӣв‘ЎйҮ‘еұһжҙ»еҠЁжҖ§пјӣв‘ўйҮ‘еұһзҡ„еҜјз”өжҖ§пјӣв‘ЈйҮ‘еұһеҶ¶зӮјзҡ„йҡҫжҳ“зЁӢеәҰпјӣв‘ӨйҮ‘еұһзҡ„延еұ•жҖ§пјҺ
-
пјҲ1пјү дёӢеҲ—дәӢе®һеҸҜз”ЁдҪңжҜ”иҫғAlе’ҢFeйҮ‘еұһжҖ§ејәејұдҫқжҚ®зҡ„жҳҜгҖҖ гҖҖпјҺ
AпјҺAlзҡ„еҜјз”өжҖ§гҖҒеҜјзғӯжҖ§жҜ”FeжӣҙеҘҪ
BпјҺAlпјҲOHпјү3еҸҜжә¶дәҺNaOHжә¶ж¶ІпјҢFeпјҲOHпјү3дёҚжә¶дәҺNaOHжә¶ж¶І
CпјҺзӣёеҗҢиҙЁйҮҸзҡ„AlзүҮе’ҢFeзүҮпјҢжҠ•е…ҘеҲ°зӯүжө“еәҰзҡ„зЁҖзЎ«й…ёжә¶ж¶ІдёӯпјҢAlзүҮдә§з”ҹж°ўж°”жӣҙеӨҡ
DпјҺеңЁйҮҺеӨ–еҲ©з”Ёй“қзғӯеүӮз„ҠжҺҘй“ҒиҪЁ
-
пјҲ2пјү иҲӘжҜҚеңЁжө·жҙӢдёӯиЎҢ驶时пјҢиҲ°дҪ“еҸ‘з”ҹзҡ„з”өеҢ–еӯҰи…җиҡҖзұ»еһӢдёә пјҢе…¶дёӯжӯЈжһҒеҸ‘з”ҹзҡ„з”өжһҒеҸҚеә”ејҸдёә
-
пјҲ3пјү еҸ–a g Cuп№ЈAlеҗҲйҮ‘ж ·е“Ғз”ЁзЁҖзЎқй…ёе®Ңе…Ёжә¶и§ЈеҗҺпјҢеҶҚеҠ е…ҘиҝҮйҮҸNaOHпјҢ然еҗҺиҝҮж»ӨгҖҒжҙ—ж¶ӨгҖҒзғҳе№ІгҖҒзҒјзғ§еҫ—a gеӣәдҪ“пјҢеҲҷеҗҲйҮ‘дёӯCuзҡ„иҙЁйҮҸеҲҶж•°дёә
-
пјҲ4пјү Alп№ЈMgеҗҲйҮ‘з„ҠжҺҘеүҚз”ЁNaOHжә¶ж¶ІеӨ„зҗҶй“қиЎЁйқўAl2O3иҶңпјҢе…¶еҢ–еӯҰж–№зЁӢејҸдёә
-
пјҲ5пјү еҸ–йҖӮйҮҸAlп№ЈMgеҗҲйҮ‘ж ·е“ҒзҪ®дәҺзғ§жқҜдёӯпјҢеҠ е…Ҙ20mL 1molвҖўLп№Ј1зҡ„NaOHжә¶ж¶ІпјҢжҒ°еҘҪе®Ңе…ЁеҸҚеә”пјҺдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜгҖҖ гҖҖпјҺ
AпјҺMgдҪңиҙҹжһҒпјҢAlдҪңжӯЈжһҒ
BпјҺиҜҘеҸҚеә”йҖҹзҺҮжҜ”зәҜй“қдёҺNaOHжә¶ж¶Ізҡ„еҸҚеә”йҖҹзҺҮеҝ«
CпјҺиӢҘжҠҠNaOHдёӯзҡ„HжҚўжҲҗDпјҲDдёәйҮҚж°ўпјүпјҢз”ҹжҲҗзҡ„ж°ўж°”дёӯDдёҺHзү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә1пјҡ2
DпјҺиӢҘеҠ е…Ҙзҡ„жҳҜ20mL 1molвҖўLп№Ј1зҡ„зӣҗй…ёпјҢеҲҷж”ҫеҮәзҡ„ж°ўж°”зҡ„зү©иҙЁзҡ„йҮҸеҮҸе°‘
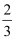 пјҺ
пјҺ
в‘ MпјҢNз”ЁеҜјзәҝзӣёиҝһеҗҺпјҢеҗҢж—¶жҸ’е…ҘзЁҖH2SO4дёӯпјҢMжһҒдёәиҙҹжһҒ
в‘ЎPпјҢQз”ЁеҜјзәҝзӣёиҝһеҗҺпјҢеҗҢж—¶жөёе…ҘзЁҖH2SO4дёӯпјҢз”өеӯҗз”ұPвҶ’еҜјзәҝвҶ’Q
в‘ўMпјҢPзӣёиҝһеҗҺпјҢеҗҢж—¶жөёе…ҘзЁҖH2SO4 пјҢ PжһҒдә§з”ҹеӨ§йҮҸж°”жіЎ
в‘ЈNпјҢQзӣёиҝһеҗҺпјҢеҗҢж—¶жөёе…ҘзЁҖH2SO4дёӯпјҢQжһҒеҸ‘з”ҹж°§еҢ–еҸҚеә”
з”ұжӯӨеҲӨж–ӯеӣӣз§ҚйҮ‘еұһзҡ„жҙ»еҠЁжҖ§йЎәеәҸдёәпјҲВ В пјү
в‘ X+YпјҲNO3пјү2=XпјҲNO3пјү2+Y в‘ЎX+H2SO4пјҲзЁҖпјүвү
в‘ўM+H2SO4пјҲзЁҖпјү=MSO4+H2вҶ‘ в‘ЈN+MSO4=NSO4+MпјҺ


| е®һйӘҢиЈ…зҪ® | | | | |
| йғЁеҲҶе®һйӘҢзҺ°иұЎ | aжһҒиҙЁйҮҸеҮҸе°Ҹ bжһҒиҙЁйҮҸеўһеҠ | bжһҒжңүж°”дҪ“дә§з”ҹ cжһҒж— еҸҳеҢ– | dжһҒжә¶и§Ј cжһҒжңүж°”дҪ“дә§з”ҹ | з”өжөҒи®ЎжҢҮзӨәеңЁеҜјзәҝдёӯ з”өжөҒд»ҺaжһҒжөҒеҗ‘dжһҒ |
з”ұжӯӨеҸҜеҲӨж–ӯиҝҷеӣӣз§ҚйҮ‘еұһзҡ„жҙ»еҠЁжҖ§йЎәеәҸжҳҜ( )
йҖүйЎ№ | е®һйӘҢж“ҚдҪңе’ҢзҺ°иұЎ | з»“и®ә |
A | еҗ‘Ca(ClO)2жә¶ж¶ІдёӯйҖҡе…ҘSO2ж°”дҪ“пјҢжңүжІүж·Җз”ҹжҲҗ | й…ёжҖ§пјҡH2SO3>HClO |
B | е°‘йҮҸZnзІүеҠ 1.0molвҖўL-1Fe2(SO4)3еҲ°жә¶ж¶ІдёӯпјҢжә¶ж¶ІйўңиүІеҸҳжө… | йҮ‘еұһZnжҜ”Feжҙ»жіј |
C | еҗ‘еҗ«жңүе°‘йҮҸCuCl2зҡ„MgCl2жә¶ж¶ІдёӯпјҢж»ҙеҠ еҮ ж»ҙж°Ёж°ҙпјҢдә§з”ҹи“қиүІжІүж·Җ | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
D | 0.1molвҖўL-1H2C2O4жә¶ж¶Іе’Ң0.1molвҖўL-1HNO3жә¶ж¶Ізҡ„pHеҲҶеҲ«дёә1.3е’Ң1.0 | Nзҡ„йқһйҮ‘еұһжҖ§ејәдәҺC |







