钠的氧化物 知识点
过氧化钠:钠在氧气或空气中燃烧的产物之一,纯品过氧化钠为白色,但一般见到的过氧化钠呈淡黄色,原因是反应过程中生成了少量超氧化钠(NaO₂,为淡黄色)。过氧化钠易潮解、有腐蚀性,应密封保存。过氧化钠具有强氧化性,可以用来漂白纺织类物品、麦杆、纤维等。
钠的氧化物 知识点题库
Na2O2可用作漂白剂和呼吸面具中的供氧剂.
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生.
①使酚酞溶液变红是因为 ,红色褪去的可能原因是 .
②加入MnO2反应的化学方程式为 .
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应.为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下.
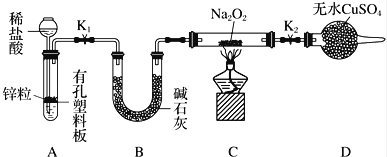
步骤1:按上图组装仪器(图中夹持仪器省略),检查气密性,装入药品.
步骤2:打开K1、K2 , 产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象.
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色.
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1 .
①添加稀盐酸的仪器名称是 ;B装置的作用是 .
②必须检验氢气纯度的原因是 .
③设置装置D的目的是 .
④你得到的结论是 (若能反应请用化学方程式表示).
-
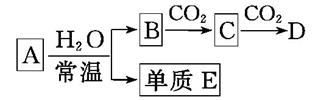
(1) 若A为Na ,则E为, A与水反应的离子方程式为
-
(2) 若A为Na2O2 ,则E为, A与CO2反应的化学方程式为,每有1mol Na2O2参加反应,转移电子数为NA
-
(3) ①A不论是Na还是Na2O2,依据转化关系判断物质B是物质C是
②向饱和的C溶液中通入CO2会析出白色晶体,该晶体为,用化学方程式表示其反应原理为:
③将1mol/L的B溶液逐滴加入到1L1mol/L的AlCl3溶液中,产生白色沉淀39g,则所加入的B溶液的体积可能为L或者L
![]()
-
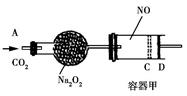
(1) 写出A的电子式。
-
(2) 用离子方程式表示X的水溶液呈酸性的原因 。
-
(3) 写出上述转化中C→D对应反应的离子方程式。
 、②HCO
、②HCO  、③SO
、③SO  、④CO
、④CO  、⑤SO
、⑤SO  五种阴离子。向其中加入足量的Na2O2固体后,溶液中的离子浓度减小的是(忽略溶液体积变化)( )
五种阴离子。向其中加入足量的Na2O2固体后,溶液中的离子浓度减小的是(忽略溶液体积变化)( )
-
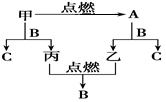
(1) A的化学式:,B的化学式:。
-
(2) 写出甲+B反应生成C+丙的化学方程式:
-
(3) 写出A的一种重要用途:。
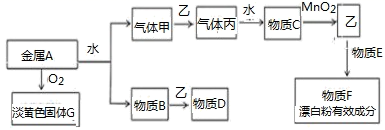
请根据以上信息回答下列问题:
-
(1) 写出下列物质的名称:丙;
-
(2) 写出下列物质的化学式:F;G。
-
(3) 气体乙是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请回答下列问题:
①气体乙通入紫色石蕊溶液中,可以观察到的现象是:, 请你解释其中的原因。
②某化学兴趣小组计划用气体乙和物质B制取简易消毒液D其反应原理为:(用化学方程式表示) 。
③实验室常用烧碱溶液吸收Cl2氯气与氢氧化钠在70℃时反应,生成物中NaClO3和NaClO 的物质的量之比为 3:1 的离子方程式。
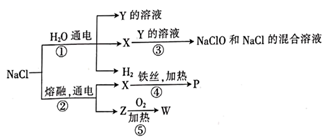
-
(1) 物质Y、P的化学式依次为、。
-
(2) 可用于工业制漂白液的是反应(填序号),该离子方程式为。
-
(3) 物质W可在中作氧气供给剂。物质W与水反应的过程中,体现了物质W具有的性质是(填“氧化性”“还原性”或“氧化性和还原性”)。
-
(4) 将一定量的CO2通入Y的溶液中至Y完全反应,得到两种盐的混合溶液,鉴别这两种盐可采用的方法。
 2Na+Cl2↑。根据所学知识回答下列有关问题:
2Na+Cl2↑。根据所学知识回答下列有关问题:
-
(1) 实验室保存金属钠的正确方法是(填序号)。
A. 放在棕色瓶中 B.放在细沙中 C. 放在水中 D .放在煤油中
-
(2) 将一小块金属钠放在干燥的坩埚中,用酒精灯加热充分反应,发生反应的化学方程式为,生成物的颜色为。
-
(3) 将Na、Na2O、Na2O2、NaOH久置于空气中,最终都是变为(填化学式)。
-
(4) NaOH是实验室中最常用的试剂之一。实验室进行某实验需要0.5 mol·L-1的氢氧化钠溶液约400 mL。
①在配制溶液的过程中除了需要托盘天平(带砝码)、药匙、烧杯和玻璃棒外,还需要的其他玻璃仪器是;
②根据计算得知,需用托盘天平(带砝码)准确称量NaOH固体g。
-
(5) 过氧化钠常用作漂白剂、杀菌消毒剂。某兴趣小组以过氧化钠为对象进行如下探究:“干燥的CO2不能与Na2O2反应”和“CO2在有水存在时才能与Na2O2反应”,设计如下实验装置:
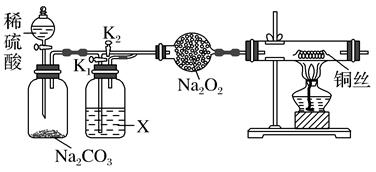
连接装置,检查气密性。在干燥管中装入Na2O2后,打开活塞加入稀硫酸,生成CO2。打开K1 , 关闭K2 , 一段时间后再加热铜丝。其中,X中应加入试剂(填名称)。先通一段时间CO2的目的是,实验观察到铜丝未变化,则得出结论“干燥的CO2不能与Na2O2反应”。若打开K2 , 关闭K1 , 出现现象,可证明“有水时CO2与Na2O2反应”产生了O2。
-
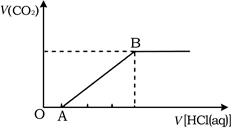
(6) 将一定量的CO2通入NaOH溶液中,再向所得溶液中逐滴滴加盐酸,所得气体的体积与加入盐酸的体积关系如图所示,其中OA段发生的离子反应方程式为。
 和
和 固体混合,在密闭容器中隔绝空气加热到质量不再变化时排出气体,所得残留物是( )
固体混合,在密闭容器中隔绝空气加热到质量不再变化时排出气体,所得残留物是( )
 、NaOH
B .
、NaOH
B .  C .
C .  、
、 D . NaOH、
D . NaOH、
 悬浊液中加入几滴
悬浊液中加入几滴 溶液,沉淀变为红褐色:
溶液,沉淀变为红褐色: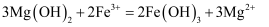 B . 过氧化钠用作潜水艇中的供氧剂:
B . 过氧化钠用作潜水艇中的供氧剂: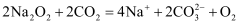 C . 收集的酸雨过一段时间后pH值会减小:
C . 收集的酸雨过一段时间后pH值会减小: D . 工业上用情性电极电解饱和氯化钠溶液生产氢氧化钠:
D . 工业上用情性电极电解饱和氯化钠溶液生产氢氧化钠:



