钠的氧化物 知识点题库
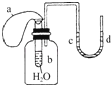
如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知,过氧化钠与水反应是放热的.将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将发生的现象是( )
-
(1) 若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,该反应离子方程式为.
-
(2) 若A为淡黄色固体,C为无色的气体,则该反应的离子方程式为.
-
(3) 若A、C、D均是铁的化合物,B是稀硫酸,则A与B反应的化学方程式为.
-
(1) I.呼吸面具中,Na2O2起反应的化学方程式为。
-
(2) 印刷电路板由高分子材料和铜箔复合而成,用FeCl3溶液刻制印刷电路时,发生的反应离子方程式为。
-
(3) 把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的物质的量浓度之比为3:2,则已反应的Fe3+和未反应的Fe3+的物质的量之比为。
-
(4) II.某一反应体系中有反应物和生成物共6种: HCl、H2SO4、SnCl2、SnCl4、FeSO4、Fe(SO4)3 , 反应前在溶液中滴加KSCN 溶液显红色,反应后红色消失。
该反应中的还原剂是。
-
(5) 写出该反应的化学方程式。
| 选项 | 现象或事实 | 解释 |
| A | 春节期间全国各地燃放的烟火 | 某些金属元素焰色反应所呈现出来色彩 |
| B | Na2O2用于呼吸面具中作为O2的来源 | Na2O2是强氧化剂,能氧化CO2、H2O生成O2 |
| C | K2FeO4用于自来水的消毒和净化 | K2FeO4具有强氧化性,被还原后生成的 Fe3+水解生成胶状物,可以净化水 |
| D | Al(OH)3用作医用的胃酸中和剂 | Al(OH)3的碱性不强,但却可以与胃酸反应 |
 2Na+Cl2↑。回答下列有关单质钠的问题:
2Na+Cl2↑。回答下列有关单质钠的问题:
-
(1) 下列各项中属于保存金属钠的正确方法是___。A . 放在棕色瓶中 B . 放在细沙中 C . 放在水中 D . 放在煤油中
-
(2) 将一小块金属钠放在干燥的坩埚中,用酒精灯加热充分反应,请写出发生反应的化学方程式:,生成物的颜色为。
-
(3) 将Na、Na2O、Na2O2、NaOH久置于空气中,最终都是变为(填化学式)。将少量金属钠投入硫酸铜溶液中写出发生的离子反应方程式。
-
(4) 过氧化钠中阴阳离子个数比为,过氧化钠常用于呼吸面具和潜水艇氧气的来源,其原理为:,。(用化学反应方程式表示)
-
(5) 将一定量的CO2通入NaOH溶液中,再向所得溶液中逐滴滴加盐酸,所得气体的体积与加入盐酸的体积关系如图所示:

①其中OA段发生的离子反应方程式为。
②达到B点时所消耗盐酸为50g,已知所用盐酸的浓度为36.5%,则原溶液中所含溶质NaOH的质量为。
①金属钠投入到CuSO4溶液中 ②NaOH溶液和CuSO4溶液混合
③金属镁投入到盐酸中 ④Na2O2投入到FeCl3溶液中
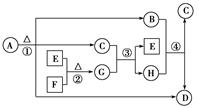
请回答下列问题:
-
(1) G的化学式为。
-
(2) 反应①②③④中(填序号)属于氧化还原反应。
-
(3) 写出下列反应的化学方程式:
A→B+C+D:。
F+C:。

提出猜想:CO2与Na反应可能生成4种物质:C、CO、Na2O和Na2CO3
查阅资料:①Na很活泼,易与O2、H2O等物质反应
②向PdCl2溶液中通入CO,能产生黑色沉淀
③Na2CO3是白色固体,易溶于水
④Na2O是白色固体,与H2O反应生成NaOH
⑤CaCl2、NaCl、Na2CO3、NaOH四种溶液分别与无色酚酞溶液作用比较:
|
分别向右侧溶液中加入无色酚酞溶液 |
CaCl2 |
NaCl |
Na2CO3 |
NaOH |
|
主要实验现象 |
无色 |
无色 |
由无色变为红色 |
由无色变为红色 |
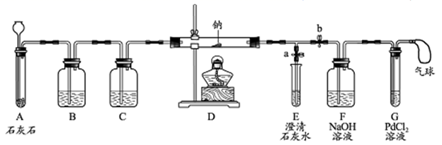
实验过程,同学们在老师的指导下设计了如图所示装置(部分夹持仪器已略去)
-
(1) 实验记录
序号
实验操作
主要实验现象
实验结论及解释
①
打开a,关闭b,由长颈漏斗注入盐酸
A中产生大量气泡
E中出现浑浊
E中反应的离子方程式为:
②
当E中出现浑浊时,打开b,关闭a,点燃酒精灯
D中Na剧烈燃烧,产生白烟,内壁附着黑色、白色固体,G中产生黑色沉淀
反应产物一定
有和
③
取D中白色固体于试管中,加水溶解,再加入几滴CaCl2溶液
产生白色沉淀
反应产物还有
-
(2) 实验反思
①实验记录②中,E中出现浑浊再点燃酒精灯的目的是
②C中的试剂是
③检验第4种物质是否存在的实验方案:取D中白色固体于试管中,
-
(1) 用如图装置制备纯净的CO2
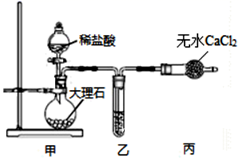
①甲装置中盛放稀盐酸的仪器名称是。
②丙装置的作用是。
-
(2) 按照下图进行实验(夹持装置略)。
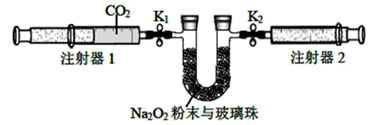
①先组装仪器,然后,再用注射器1抽取100 mL纯净的CO2 , 将其连接在K1处,注射器2的活塞推到底后连接在K2处,具支U形管中装入足量的Na2O2粉末与玻璃珠。
②打开止水夹K1、K2 , 向右推动注射器1的活塞,可观察到的现象是。
③实验过程中,需缓慢推入CO2 , 其目的是,反应的化学方程式。
-
(3) 实验结束后,当注射器1的活塞推到底时,测得注射器2中气体体积为65 mL,则反应消耗CO2的体积是。

|
选项 |
现象或事实 |
解释 |
|
A |
Na2O2常用于潜水艇或呼吸面具的供氧剂 |
Na2O2与H2O、CO2反应产生O2 |
|
B |
常用铁盐做净水剂 |
Fe3+生成吸附能力强的Fe(OH)3胶体 |
|
C |
FeCl3溶液可用于刻制印刷铜电路板 |
发生反应2Fe3++Cu=2Fe2++Cu2+ |
|
D |
在医疗上烧碱可用于治疗胃酸过多 |
烧碱可与胃酸反应 |
-
(1) 反应中生成的氢气为g;
-
(2) 钠的质量为g;
-
(3) 被氧化的钠的质量为g;
-
(4) 氧化钠的质量分数为(保留三位有效数字)。
| 氨气的水溶液能导电 | 氨气是电解质 |
| 次氯酸有强氧化性 | 漂白粉在空气中久置会变质 |
|
|
|
| 常温下浓硫酸与铁、铝不发生反应 | 可用铁罐、铝罐储存或运输冷的浓硫酸 |
 B .
B .  C .
C .  D .
D . 
 能与
能与 反应产生
反应产生



