纯碱工业(侯氏制碱法) 知识点题库
NH3+CO2+H2O=NH4HCO3
NH4HCO3+NaCl=NaHCO3↓+NH4Cl
2NaHCO3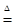 Na2CO3+CO2↑+H2O↑
Na2CO3+CO2↑+H2O↑
-
(1) 碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是________(填字母标号)。A . 碳酸氢钠难溶于水 B . 碳酸氢钠受热易分解 C . 碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
-
(2) 某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方法实验。
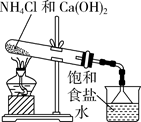
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出):

试回答下列有关问题:
(Ⅰ)乙装置中的试剂是;
(Ⅱ)丁装置中稀硫酸的作用是。
(Ⅲ)实验结束后,分离出NaHCO3晶体的操作是(填分离操作的名称)。
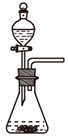
②另一位同学用下图中戊装置(其他装置未画出)进行实验:
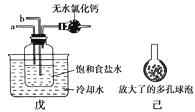
(Ⅰ)实验时,须先从管通入气体,再从管通入气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,原因是。
-
(3) 请你再写出一种实验室制取少量碳酸氢钠的方法:。
-
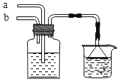
(1) 沉淀池中发生反应的化学方程式为;
-
(2) X是,Y是(填化学式);
-
(3) 从理论上分析,在氨碱法生产过程中(填“需要”、“不需要”)补充氨气,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为;
-
(4) 根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是;
a.常温时氯化铵的溶解度比氯化钠小 b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
-
(5) 相比于氨碱法,指出联碱法的一项优点.
I.工业生产纯碱的工艺流程示意图如下:

-
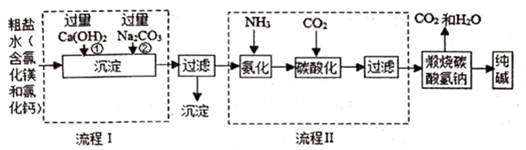
(1) 为除去粗盐水中的Mg2+、Ca2+、SO42-等杂质离子,加入试剂顺序合理的是________。A . 碳酸钠、氢氧化钠、氯化钡 B . 碳酸钠、氯化钡、氢氧化钠 C . 氢氧化钠、碳酸钠、氯化钡 D . 氯化钡、氢氧化钠、碳酸钠
-
(2) 工业生产纯碱工艺流程中,碳酸化时产生的现象是。
-
(3) 碳酸化后过滤,滤液A最主要的成分是(填写化学式),检验这一成分的阴离子的具体方法是:。
-
(4) 煅烧制取Na2CO3在(填字母序号)中进行。
a.瓷坩埚 b.蒸发皿 c.铁坩埚 d.氧化铝坩埚
-
(5) II.纯碱在生产生活中有广泛的用途。
工业上,可能用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与氯气反应可制得有效成分为次氯酸钠的消毒液,其反应的离子方程式为。
-
(6) 纯碱可制备重铬酸钠(Na2Cr2O7),铬铁矿中的1molCr2O3反应时需要通入标准状况下O2的体积为。

已知:反应Ⅱ包含2NaHSO3 ⇌Na2S2O5+H2O等多步反应.
-
(1) 反应I的化学方程式为:.
-
(2) 已知Na2S2O5与稀硫酸反应放出SO2 , 其离子方程式为:.
-
(3) 反应I时应先通的气体为,副产品X的化学式是.
-
(4) 为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为.检验产品中含有碳酸钠杂质所需试剂是(填编号)
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水
④饱和碳酸氢钠溶液 ⑤NaOH ⑥稀硫酸.
-
(1) (一)以一氯代乙酸钠(CH2ClCOONa)水溶液为原料,通过电解法可以制备1,2-二氯乙烷(CH2ClCH2Cl),装置如图1所示。
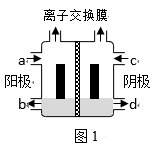
所用的离子交换膜是(填“阳”或“阴”)离子交换膜。
-
(2) 写出电解池总反应。
-
(3) (二)1940年,我国著名化工专家侯德榜先生成功冲破了“索尔维”法的技术封锁,并加以改进,用NaCl固体代替生石灰,加入母液,并联合合成氨厂一起生产出纯碱和氯化铵。这便是举世闻名的“侯氏联合制碱法”,工艺流程如图2。
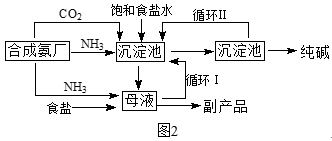
请回答:
关于合成氨反应,下列说法合理的是___。
A . 反应体系中一般用V2O5作催化剂 B . 因为该反应ΔS小于零,所以反应的ΔH一定也小于零 C . 因为该反应的ΔS小于零,所以反应的压强控制越高越好 D . 该反应往往控制在500℃左右,是因为该温度下反应物转化率最高 -
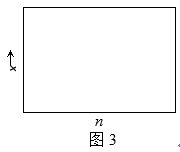
(4) 一定温度下合成氨反应的平衡常数K=48。若在该温度下,在9L的恒容容器中投入1mol氮气和3mol氢气进行反应,则氨气的平衡产率y=;若氮气和氢气的物质的量之比为n∶1,相应平衡体系中氨气的物质的量分数为x,请在图3中绘制x随n变化的示意图(计算时不计副反应)。
-
(5) 侯氏制碱法最大的优点是使原料氯化钠的利用率从70%提高到90%以上,主要是设计了(填上述编号)的循环。
-
(6) 关于侯氏联合制碱法,下列说法合理的是_____。A . 往沉淀池中先通入CO2再通入氨气的目的是提高NaHCO3的产量 B . 往母液中加入食盐的目的是使NaHCO3更多地析出 C . 从母液中经过循环Ⅰ进入沉淀池的主要是Na2CO3、NH4Cl和氨水 D . 往母液中通氨气目的仅仅是增大NH4+的浓度,使NH4Cl更多地析出
| 选项 | A. | B. | C. | D. |
| 实验操作 | | | | |
| 实验目的 | 制取氨气将其溶于饱和食盐水 | 用碳酸钠与稀硫酸制二氧化碳 | 过滤获得碳酸钠晶体 | 蒸发浓缩氯化铵溶液 |
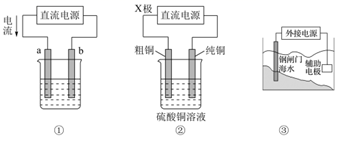
 H2↑+Cl2↑+2OH-
D . 图③装置中钢闸门应与外接电源的负极相连以实现牺牲阳极的阴极保护法
H2↑+Cl2↑+2OH-
D . 图③装置中钢闸门应与外接电源的负极相连以实现牺牲阳极的阴极保护法
-
(1) I.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:
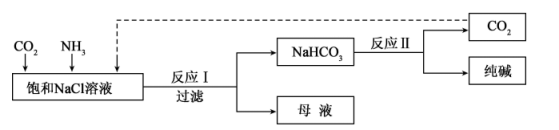
已知NaHCO3在低温下溶解度较小。
反应I的化学方程式为。
-
(2) 反应II的化学方程式为。
-
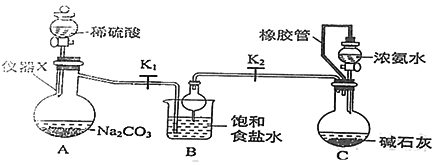
(3) II.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。
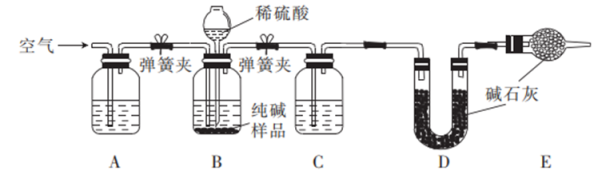
检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若,说明装置不漏气。
-
(4) 装置A中的试剂为,装置C中的试剂为。
-
(5) 实验结束后通入空气的目的:。
-
(6) 实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中Na2CO3的质量分数为(保留小数点后一位);若缺少E装置,会使测定结果(填“偏高”或“偏低”)。
 之间,对光线的散射形成的
B . 同温同压下,两种气体的体积不同,是因为分子体积不同
C . 英国科学家道尔顿于1803年提出原子学说,为近代化学的发展奠定了基础
D . 侯德榜发明联合制碱法,为我国的化学工业发展和技术创新作出了重要贡献
之间,对光线的散射形成的
B . 同温同压下,两种气体的体积不同,是因为分子体积不同
C . 英国科学家道尔顿于1803年提出原子学说,为近代化学的发展奠定了基础
D . 侯德榜发明联合制碱法,为我国的化学工业发展和技术创新作出了重要贡献
 和
和 析出
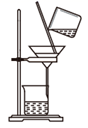
析出 , 过滤后热分解得纯碱。实验室模拟工业制纯碱,能达到实验目的是( )
, 过滤后热分解得纯碱。实验室模拟工业制纯碱,能达到实验目的是( )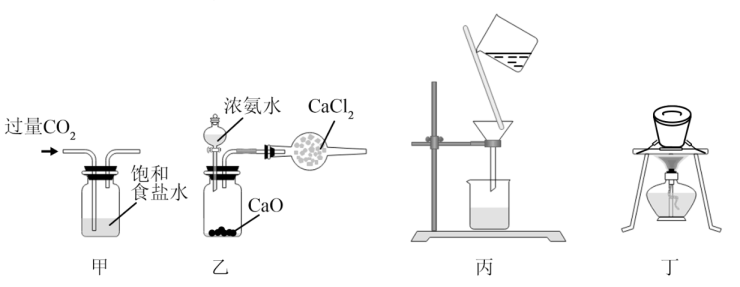
 B . 用装置乙制取干燥氨气
C . 用装置丙分离出
B . 用装置乙制取干燥氨气
C . 用装置丙分离出 固体
D . 用装置丁分解
固体
D . 用装置丁分解 制备
制备