纯碱工业(侯氏制碱法) 知识点题库
下列关于工业生产的说法正确的是( )
A . 在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气
B . 在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C . 在氯碱工业,电解槽一般用铁网作电极
D . 合成氨工业用天然气造气的方法中,与水蒸汽高温反应优于热分解法
下列与化学有关的说法中错误的是( )
A . 侯氏制碱、肥皂的制取工艺过程中均应用了物质溶解度的差异
B . 可用蘸浓氨水的棉棒检验输送氯气的管道是否漏气
C . 石油分馏、煤的气化、海水晒盐、碱去油污、花生中提取花生油等过程都是物理变化
D . 利用钠的性质制造的高压钠灯,可发出射程远、透雾能力强的黄光
我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理制备纯碱.如图是在实验室进行模拟实验的生产流程示意图:气体A的饱和溶液 A和食盐的饱和溶液
A和食盐的饱和溶液 悬浊液
悬浊液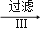 晶体
晶体 纯碱,则下列叙述错误的是( )
纯碱,则下列叙述错误的是( )
 A和食盐的饱和溶液
A和食盐的饱和溶液 悬浊液
悬浊液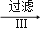 晶体
晶体 纯碱,则下列叙述错误的是( )
纯碱,则下列叙述错误的是( )
A . A气体是NH3 , B气体是CO2
B . 第Ⅲ步得到的晶体是发酵粉的主要成分
C . 第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D . 第Ⅳ步操作的主要过程有溶解、蒸发、结晶
[选修2--化学与技术]下列单元操作中采用了热交换设计的有( )
A . 电解食盐水制烧碱
B . 合成氨中的催化合成
C . 硫酸生产中的催化氧化
D . 氨碱法中的氨盐水碳酸化
工业上用粗盐(含Ca2+、Mg2+、SO42﹣等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,工艺流程如下图所示.下列有关说法正确的是 ( )
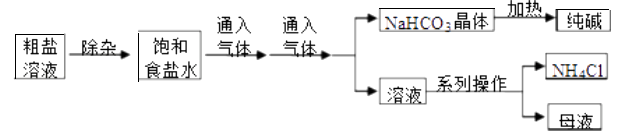
A . 对粗盐溶液除杂可依次加入NaOH,Na2CO3、BaCl2 , 再加入盐酸调节溶液pH
B . 饱和食盐水中先通入的气体为CO2
C . 流程图中的系列操作中一定需要玻璃棒
D . 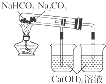 如图所示装置可以比较Na2CO3和NaHCO3晶体的热稳定性
如图所示装置可以比较Na2CO3和NaHCO3晶体的热稳定性
 如图所示装置可以比较Na2CO3和NaHCO3晶体的热稳定性
如图所示装置可以比较Na2CO3和NaHCO3晶体的热稳定性
图是模拟“侯氏制碱法”制取NaHCO3的部分装置.下列操作正确的是( )
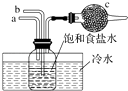
A . a通入CO2 , 然后b通入NH3 , c中放碱石灰
B . a通入NH3 , 然后b入CO2 , c中放蘸稀硫酸的脱脂棉
C . b通入NH3 , 然后a通入CO2 , c中放碱石灰
D . b通入CO2 , 然后a通入NH3 , c中放蘸稀硫酸的脱脂棉
我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如图1所示:
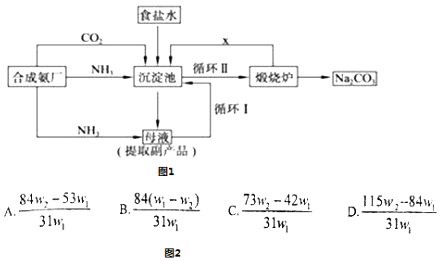
请回答下列问题:
-
(1) 往饱和食盐水中通入足量的NH3、CO2 , 先通.
-
(2) 从生产流程图可知,可循环的物质是.
-
(3) 写出生产流程中的化学方程式.
-
(4) 为了检验含有NaHCO3杂质的Na2CO3产品的纯度,现将W1g产品加热到恒重,其质量为W2g,则该产品的纯度(质量分数)是图2中的.
实验室根据侯氏制碱原理制备少量 NaHCO3 固体的四个主要步骤中,不能实现实验目的的是( )
A . 制取氨气 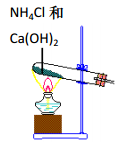 B . 制取碳酸氢钠
B . 制取碳酸氢钠 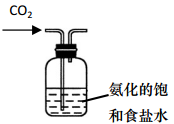 C . 分离碳酸氢钠
C . 分离碳酸氢钠  D . 干燥碳酸氢钠
D . 干燥碳酸氢钠 
 B . 制取碳酸氢钠
B . 制取碳酸氢钠  C . 分离碳酸氢钠
C . 分离碳酸氢钠  D . 干燥碳酸氢钠
D . 干燥碳酸氢钠 
1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料制得纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。
回答下列问题:
某探究活动小组欲在实验室中模拟制取纯碱,设计了Ⅰ、Ⅱ两种方案,并选择其一进行实验。
方案Ⅰ:(1)将足量CO2通入饱和NaCl溶液中;(2)再在所得溶液中通入足量NH3;(3)过滤;……。
方案Ⅱ:(1)将足量NH3通入饱和NaCl溶液中;(2)再在所得溶液中通入足量CO2;(3)过滤;……。
-
(1) 部分实验装置如图所示。制取氨气的装置应选用(选填编号)。
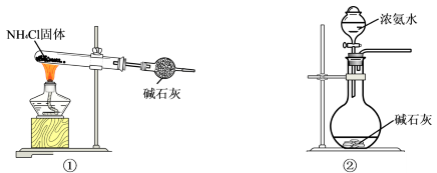
-
(2) 写出实验中获得碳酸氢钠的离子方程式
-
(3) 灼烧碳酸氢钠需要(选填编号)。
a.蒸发皿 b.坩埚 c.烧杯 d.烧瓶 e.酒精灯
-
(4) 选择的实验方案是(选填“Ⅰ”或“Ⅱ”),说明选择的理由
-
(5) 甲同学取少量产品完全溶于水,滴加稀硝酸2-3滴,再滴加硝酸银溶液,观察到有白色沉淀生成,得出纯碱含杂质Cl-的结论。乙同学认为甲的结论不一定正确,你认为乙同学的理由是。
-
(6) 按下列流程处理母液(提取完碳酸氢钠后的滤液)可得到NH4Cl。

通入NH3的作用是(选填编号)。操作a是,操作b是。
a.增大NH4+浓度,使NaHCO3更多地析出
b.增大NH4+浓度,使NH4Cl更多地析出
c.使NaHCO3转化为溶解度更大的Na2CO3 , 提高析出的NH4Cl纯度
下列说法不正确的是( )
A . 工业合成氨是一种人工固氮方法
B . 侯氏制碱法应用了物质溶解度的差异
C . 播撒碘化银可实现人工降雨
D . 铁是人类最早使用的金属材料
我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献,如图所示是某厂应用“侯氏制碱法”生产纯碱的工艺流程图,据图回答:

-
(1) 上述流程图中,可循环利用的物质是。
-
(2) 流程Ⅰ后过滤所得滤液中含有的溶质有。
-
(3) 流程Ⅱ先通入氨气,再通入二氧化碳,如果反过来,二氧化碳的吸收率会降低,这是因为。
-
(4) 用一个化学反应方程式表示出流程Ⅱ中发生的总反应。
-
(5) 工业生产纯碱的流程中,碳酸化时溶液中先析出碳酸氢钠而没有析出氯化铵的原因是。
下列有关化学反应的叙述正确的是( )
A . CuSO4稀溶液与Na反应析出Cu
B . Fe与水蒸气在高温下反应生成Fe2O3
C . SO2的水溶液与溴蒸气反应富集溴
D . 饱和食盐水与通入的NH3、CO2反应析出Na2CO3固体
下列物质的转化在给定条件下能实现的是( )
① 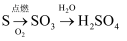
② 
③饱和  溶液
溶液 
④ 
⑤ 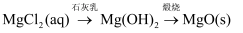
A . ①②③
B . ②③⑤
C . ②③④
D . ②④⑤
某科研小组利用有机胺(TBA)参与联合生产碳酸氢钠和二氯乙烷的工艺流程如图所示。
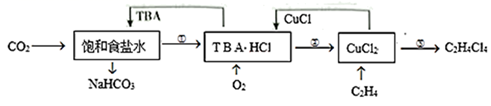
下列说法错误的是( )
A . 过程①中的TBA替代了侯德榜制碱法中的氨气
B . 过程②的反应为 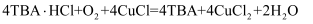 C . 理论上每产生
C . 理论上每产生  需要
需要 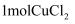 D . 流程中可循环利用的物质是TBA、CuCl
D . 流程中可循环利用的物质是TBA、CuCl
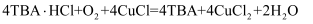 C . 理论上每产生
C . 理论上每产生  需要
需要 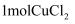 D . 流程中可循环利用的物质是TBA、CuCl
D . 流程中可循环利用的物质是TBA、CuCl
食盐在工业上应用广泛。用电解饱和食盐水的方法生产氯气和烧碱:向已经氨化的饱和食盐水中通入CO2 , 会析出碳酸氢钠晶体,加热碳酸氢钠得到碳酸钠。
-
(1) 食盐溶于水发生电离,其电离方程式。
-
(2) 2004年4月15日,某化工厂发生氯气泄漏事件,工作人员喷射NaOH溶液形成液幕,包围并吸收泄漏的氯气,其反应原理为(用化学方程式表示)。
-
(3) 事件过后,附近居民向记者反映当时晾在外面的衣服褪色了,其原因是(结合化学方程式解释)。
-
(4) 碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
①饱和食盐水中先通入NH3达饱和,再通入CO2至饱和,会析出碳酸氢钠晶体,写出该反应的化学方程式。将碳酸氢钠溶于水,溶液显性。(填“酸”、“碱”或“中”)。
②碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的化学方程式为。等物质的量的碳酸钠和碳酸氢钠分别与足量盐酸反应时生成CO2的量,前者后者(填“>”、“<”或“=”)。
③除去碳酸钠固体中碳酸氢钠的反应的化学方程式为。
侯德榜先生是我国现代化学工业的开拓者和奠基者,他于1943年发明的侯氏制碱法工艺流程如图所示:
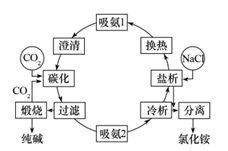
下列说法错误的是( )
A . 该工艺中循环利用的物质为CO2和NH3
B . 该工艺主产品是纯碱,副产品为NH4Cl
C . “过滤”后的母液中,n(Na)小于n(Cl)
D . 该工艺中涉及化合反应、复分解反应和分解反应
下列关于物质制备的说法正确的是( )
A . 可用电解饱和食盐水的方法制取金属钠
B . 工业上主要用Na2O和H2O反应制取NaOH
C . 工业上用氯气与澄清石灰水反应制取漂白粉
D . 侯氏制碱法的原料有食盐、氨、二氧化碳,最终制得碳酸钠
纯碱是重要化工产品,侯氏制碱法是由我国著名化学家侯德榜所创立,打破了欧美对制碱业的垄断。其简化工艺流程如下图:
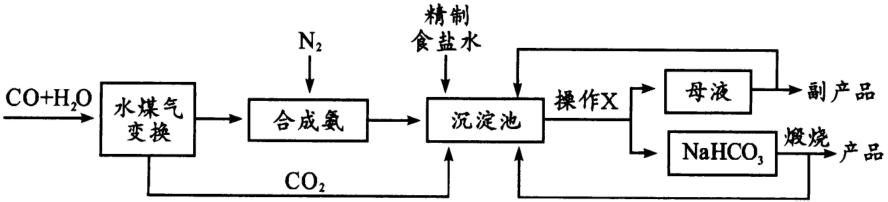
回答下列问题:
-
(1) 高温下“水煤气变换”可制取合成氨的原料气体(填化学式);沉淀池中反应的化学方程式为,该反应是否符合复分解反应发生的条件?(填“是”或“否”)
-
(2) 流程中的操作
 为;“副产品”为(填化学式)。
为;“副产品”为(填化学式)。
-
(3) 流程中可循环利用的物质有。
-
(4) 产品中可能混有杂质
 , 设计实验检验。
, 设计实验检验。
下列离子方程式正确的是( )
A . 向NaClO溶液中通入 B . 惰性电极电解氯化镁溶液:
B . 惰性电极电解氯化镁溶液: C . 侯氏制碱法的原理是将二氧化碳和氨气通入饱和食盐水:
C . 侯氏制碱法的原理是将二氧化碳和氨气通入饱和食盐水: D . 硫酸铁溶液与亚硫酸钠溶液混合:
D . 硫酸铁溶液与亚硫酸钠溶液混合: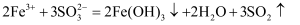
 B . 惰性电极电解氯化镁溶液:
B . 惰性电极电解氯化镁溶液: C . 侯氏制碱法的原理是将二氧化碳和氨气通入饱和食盐水:
C . 侯氏制碱法的原理是将二氧化碳和氨气通入饱和食盐水: D . 硫酸铁溶液与亚硫酸钠溶液混合:
D . 硫酸铁溶液与亚硫酸钠溶液混合: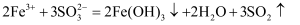
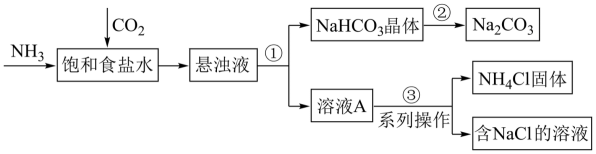
我国科学家侯德榜发明的联合制碱法,对世界制碱工业以及我国化工事业的发展做出了巨大贡献。联合制碱法的主要过程如下图所示(部分物质已省略)。
-
(1) 步骤①②③中涉及“过滤”操作的是(填序号)。
-
(2) 向饱和食盐水中通入
 和
和 后,生成
后,生成 的化学方程式是。
的化学方程式是。
-
(3) 从步骤①中分离出的
 晶体表面含有的杂质可能是和,欲得到纯净的
晶体表面含有的杂质可能是和,欲得到纯净的 , 需将其、干燥。判断
, 需将其、干燥。判断 固体已经纯净的操作和现象是。
固体已经纯净的操作和现象是。
最近更新



