纯碱工业(侯氏制碱法) 知识点题库
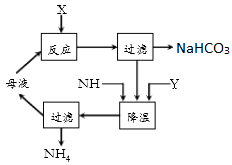
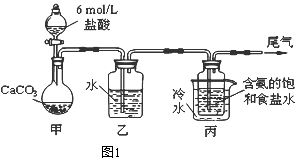
(1)装置乙的作用是 .为防止污染空气,尾气中含有的 需要进行吸收处理.
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有、 、 .NaHCO3转化为Na2CO3的化学方程式为 .
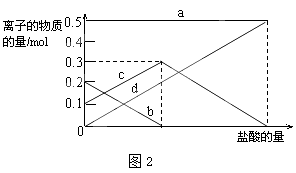
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3样品的组成进行了以下探究.取加热了t1 min的NaHCO3样品29.6g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中有关离子的物质的量的变化如图2所示.则曲线c对应的溶液中的离子是 (填离子符号);该样品中NaHCO3和Na2CO3的物质的量之比是 .
(4)若取21.0g NaHCO3固体,加热了t2 min后,剩余固体的质量为l4.8g.如果把此剩余固体全部加入到200mL 2mol•L﹣1的盐酸中则充分反应后溶液中H+的物质的量浓度为 (设溶液体积变化忽略不计).
①在含氨的饱和氯化钠溶液中通入CO2制得NaHCO3
②再将NaHCO3焙烧制得纯碱,CO2循环使用
③析出小苏打的母液中加入生石灰,NH3循环使用
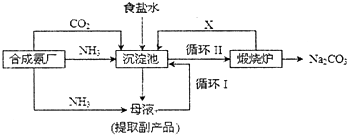
我国著名化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
-
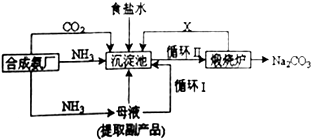
(1) 上述生产纯碱的方法称,副产品的一种用途为.
-
(2) 沉淀池中发生的化学反应方程式是.
-
(3) 写出上述流程中X物质的分子式.
-
(4) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有.
-
(5) 设计实验检验产品碳酸钠中是否含有氯化钠
-
(6) 侯德榜制碱的方法与氨碱法相比,其优点是
-
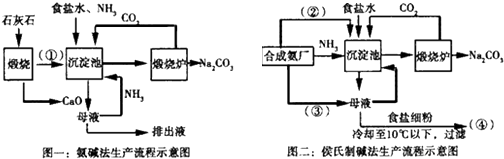
(1) 沉淀池中发生的化学反应方程式是.
-
(2) 写出上述流程中X物质的化学式.
-
(3) 使原料氯化钠的利用率从70%提高到90%以上,主要是设计了(填上述流程中的编号)的循环.从沉淀池中取出沉淀的操作是.
-
(4) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有.(填字母编号)
(a) 增大NH4+的浓度,使NH4Cl更多地析出
(b) 使NaHCO3更多地析出
(c) 使NaHCO3转化为Na2CO3 , 提高析出的NH4Cl纯度.
-
(1) 请把图中的数字用具体的化学式表示:①、②、③、④.
-
(2) “氨碱法”产生大量的CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:;“侯氏制碱法”中,在母液中通入③的目的是.
-
(3) CO2是制碱工业的重要原料,“侯氏制碱法”与“氨碱法”中CO2的来源有何不同:.
-
(4) 取“侯氏制碱法”生产的纯碱样品(设其中的杂质不与盐酸反应)11.0g配成250.00mL溶液,取25.00mL溶液用1.00mol.L﹣1的标准盐酸滴定,用酚酞作指示剂,三次滴定消耗盐酸的平均量为10.00mL.请计算纯碱样品的纯度.
-
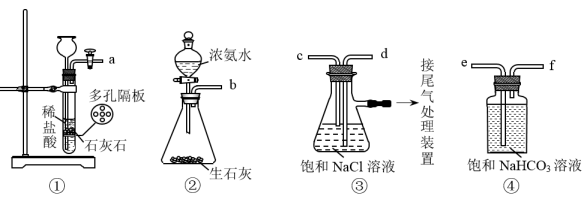
(1) Ⅰ.以下是实验室模拟制碱原理制取Na2CO3的流程图。

下表是四种物质在100g水中不同温度的溶解度
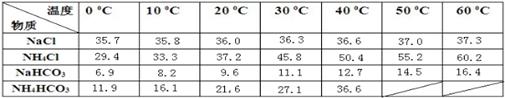
粗盐中含有的杂质离子有Ca2+、Mg2+、SO42-等。精制除杂的步骤顺序是a→→→→b(填字母编号)。
a.粗盐溶解,滤去沉渣
b.加入盐酸调pH
c.加入Ba(OH)2溶液
d.加入Na2CO3溶液
e.过滤
-
(2) 向饱和食盐水中先通入,后通入,生成固体A的化学方程式为
-
(3) Ⅱ.制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题:
方案一:把6g样品溶解后加入过量的CaCl2溶液,将所得沉淀过滤、洗涤、烘干后得到5g固体。
洗涤沉淀的具体操作是。
-
(4) 根据实验中测得的有关数据,计算纯碱样品Na2CO3的质量分数为(结果保留小数点后一位)。
-
(5) 方案二:利用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。
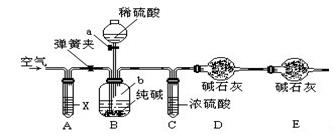
已知:碱石灰为氢氧化钠和氧化钙的混合物。
实验开始前应进行的操作是。
-
(6) 仪器a的名称为,装置A中试剂X应选用。
-
(7) 装置E的作用是。


下列说法正确的是( )
 B .
B .  C .
C . 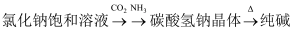 D .
D . 
 为原料制取纯碱流程如下图所示:
为原料制取纯碱流程如下图所示: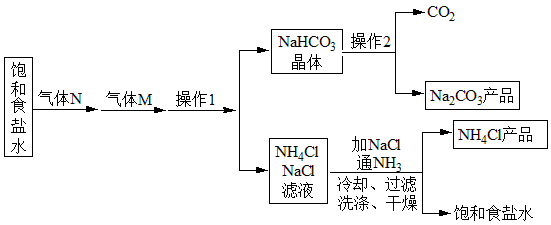
 仪器R
仪器R
下列说法正确的是( )
 为
为 , 先通
, 先通 有利于吸收
有利于吸收 B .
B .  流程中只有饱和食盐水可以循环使用
C . 操作
流程中只有饱和食盐水可以循环使用
C . 操作 为过滤,为了加快过滤速度常用玻璃棒搅拌
D . 操作
为过滤,为了加快过滤速度常用玻璃棒搅拌
D . 操作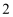 为灼烧,实验室中常在上图仪器
为灼烧,实验室中常在上图仪器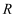 中进行
中进行
-
(1) 我国利用氯碱厂生产的H2作燃料,将氢燃料电站应用于氯碱工业,其示意图如图。
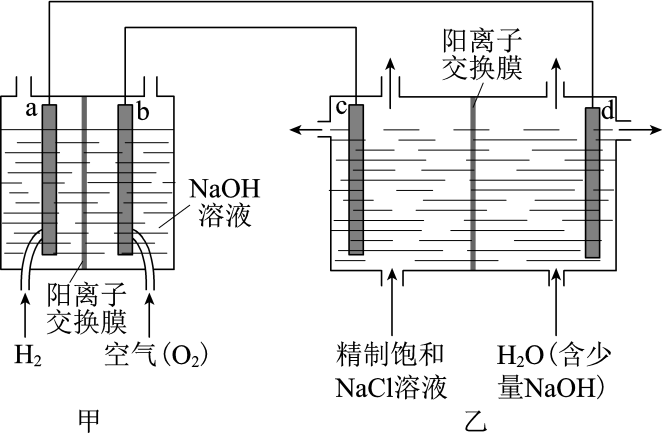
①a极为(填“正”或“负”)极。
②乙装置中电解饱和NaCl溶液的化学方程式为。
③下列说法正确的是。
A.甲装置可以实现化学能向电能转化
B.甲装置中Na+透过阳离子交换膜向a极移动
C.乙装置中c极一侧流出的是淡盐水
④结合化学用语解释d极区产生NaOH的原因:。
⑤实际生产中,阳离子交换膜的损伤会造成OH-迁移至阳极区,从而在电解池阳极能检测到O2 , 产生O2的电极反应式为。下列生产措施有利于提高Cl2产量、降低阳极O2含量的是。
A.定期检查并更换阳离子交换膜
B.向阳极区加入适量盐酸
C.使用Cl-浓度高的精制饱和食盐水为原料
-
(2) 降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2 , 避免水电离的H+直接得电子生成H2 , 降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为。
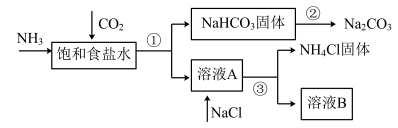
下列说法错误的是( )
 可循环使用
C . 溶液B中一定含有
可循环使用
C . 溶液B中一定含有 、
、 、
、 D . 整个制碱过程中都没有单质生成
D . 整个制碱过程中都没有单质生成



