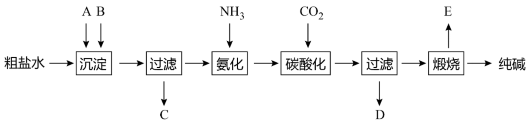
纯碱工业(侯氏制碱法) 知识点题库
纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。下列说法不正确的是 ( )
A . “联合制碱法”和“氨碱法”的化学反应原理中都有下列化学反应NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl,2NaHCO3 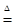 Na2CO3+H2O↑+CO2↑
B . “联合制碱法”生产中有氨的循环利用工艺
C . “氨碱法”生产中有氨的循环利用工艺
D . “联合制碱法”和“氨碱法”都有一定的局限性
Na2CO3+H2O↑+CO2↑
B . “联合制碱法”生产中有氨的循环利用工艺
C . “氨碱法”生产中有氨的循环利用工艺
D . “联合制碱法”和“氨碱法”都有一定的局限性
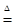 Na2CO3+H2O↑+CO2↑
B . “联合制碱法”生产中有氨的循环利用工艺
C . “氨碱法”生产中有氨的循环利用工艺
D . “联合制碱法”和“氨碱法”都有一定的局限性
Na2CO3+H2O↑+CO2↑
B . “联合制碱法”生产中有氨的循环利用工艺
C . “氨碱法”生产中有氨的循环利用工艺
D . “联合制碱法”和“氨碱法”都有一定的局限性
下列化学工业中,未涉及原料循环使用的是( )
A . 侯德榜制碱法
B . 索尔维制碱法
C . 工业电解饱和食盐水
D . 工业炼铁
以下是在实验室模拟“侯氏制碱法”生产流程的示意图:则下列叙述错误的是( )

A . A气体是NH3 , B气体是CO2
B . 把纯碱及第Ⅲ步所得晶体与某些固体酸性物质(如酒石酸)混合可制泡腾片
C . 第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D . 第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶
“侯氏制碱法”以氯化钠为原料制备纯碱,部分工艺流程如图1:
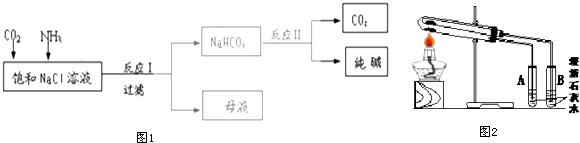
已知NaHCO3在低温下溶解度较小.反应Ⅰ为:NaCl+CO2+NH3+H2O  NaHCO3↓+NH4Cl,NH4Cl和浓碱液反应可产生NH3:
NaHCO3↓+NH4Cl,NH4Cl和浓碱液反应可产生NH3:
-
(1) 上述工艺流程中可以循环利用的物质是.
-
(2) 反应Ⅱ的化学方程式为.
-
(3) 若在Ⅱ中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1min的NaHCO3样品的组成进行了以下探究.如图2所示,取加热了t1min的NaHCO3样品加在大试管的底部,另取等质量NaHCO3粉末加在小试管底部.预热后在大试管底部加热.开始加热一段时间后,若试管(填“A”或“B”)中会出现浑浊现象,说明Ⅱ中灼烧的分解不完全;若开始时两试管中加入的固体质量相等,充分加热后,B试管中产生的沉淀的质量是A中的2倍(假设澄清石灰水足量),则反应Ⅱ中NaHCO3的分解率为.(分解率=已分解的质量/原物质的总质量)
下图是工业制纯碱的部分物质转化示意图,下列说法错误的是()
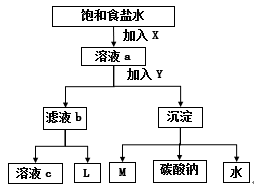
A . X是NH3 , Y是CO2
B . M可在转化流程中循环利用
C . 若是联合制碱法,则L的主要成分是NH4Cl
D . 若是氨碱法,溶液c可在转化流程中循环利用
下列说法正确的是()
A . 海水中提取镁的工业流程中,涉及到置换反应
B . 侯氏制碱工业是以氯化钠为主要原料,制得大量NaOH
C . 我国华为AI芯片已跻身于全球AI芯片榜单前列,该芯片的主要材料是二氧化硅
D . 垃圾分类是化废为宝的重要举措,厨余垃圾可用来制沼气或堆肥
下列物质的制备与工业生产相符的是( )
①NH3 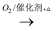 NO
NO 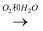 HNO3 ②浓盐酸
HNO3 ②浓盐酸  Cl2
Cl2 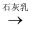 漂白粉
漂白粉
③MgCl2  无水MgCl2
无水MgCl2  Mg ④饱和NaCl
Mg ④饱和NaCl  NaHCO3
NaHCO3  Na2CO3
Na2CO3
⑤铝土矿  NaAlO2溶液
NaAlO2溶液 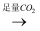 Al(OH)3
Al(OH)3  Al2O3
Al2O3  Al
Al
A . ①④⑤
B . ①③⑤
C . ②③④
D . ②④⑤
-
(1) Ⅰ“侯氏制碱法”是我国化工专家侯德榜为世界制破工业作出的突出贡献。某实验小组模拟“侯氏法”的工艺流程及实验装置(部分夹持装置省略)如下:
气体A的饱和溶液
 A与食盐的饱和溶液
A与食盐的饱和溶液  悬浊液
悬浊液  晶体
晶体  纯碱
纯碱气体A为(填化学式)。
-
(2) 工业上粗盐(含Ca2+、Mg2+、SO
 等杂质)经除杂得到氯化钠,判断氯化钠中的钠元素的具体操作为。
等杂质)经除杂得到氯化钠,判断氯化钠中的钠元素的具体操作为。
-
(3) 第Ⅲ步操作用到的主要玻璃仪器是。
-
(4) Ⅱ、某小组利用传感器探究Na2CO3和NaHCO3的性质。已知:氢氧根离子的浓度越小,溶液碱性越弱,(具体过程如图)
编号
实验操作
实验Ⅰ
测量下面实验过程中温度的变化
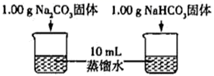
实验Ⅱ
测量下面实验过程中溶液pH的变化
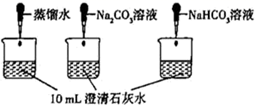
注:Na2CO3溶液和NaHCO3溶液的浓度相等
实验Ⅲ
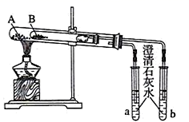
请回答:
实验Ⅰ中,溶解时吸收热量的物质是(填化学式)。
-
(5) 实验Ⅱ中,滴加NaHCO3溶液的烧杯中溶液酸碱性变化与滴加Na2CO3溶液的有明显差异,原因是滴加NaHCO3溶液的烧杯中,(填离子符号)参与了反应。
-
(6) 若用方法Ⅲ验证Na2CO3和NaHCO3的稳定性,则试管B中装入的固体是 (填化学式)。由此可知方法Ⅲ(填“能”或“不能”)鉴别Na2CO3和NaHCO3。
关于下列工业生产过程,说法正确的是( )
A . 工业上电解冶炼铝,由于Al2O3熔点高,可用AlCl3代替
B . 氯碱工业中,选用阳离子交换膜,除了平衡电荷的作用外还可避免气体产物接触出现危险
C . 侯氏制碱法中,在沉淀池中反生反应时,应向饱和食盐水中先通二氧化碳后通氨气
D . 生产普通玻璃的主要原料为石灰石、纯碱和晶体硅
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列说法正确的是( )
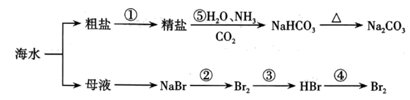
A . 步骤①是指蒸发结晶
B . 步骤⑤是先通CO2再通NH3
C . 在步骤②、③、④中,溴元素均被氧化
D . 制取NaHCO3的反应是利用其溶解度在常温下小于NaCl和NH4HCO3
我国近代化学工业的奠基人之一侯德榜发明的“侯氏制碱法”,将制碱技术发展到了一个新的水平,在此基础上,将工业纯碱(含Mg2+、Fe3+、Cl-等杂质)进行提纯。工艺流程如下:
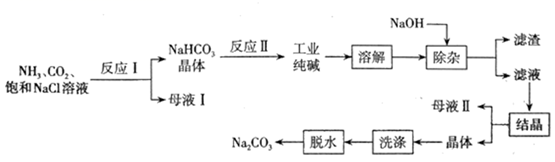
请回答下列问题。
-
(1) 母液I中含有NH4Cl,NH4Cl的电离方程式是。
-
(2) 反应II的化学方程式是。
-
(3) 流程中加入NaOH除去的杂质离子是。
-
(4) 结晶后的Na2CO3晶体表面附着有NaCl等杂质,需洗涤除去。检验NaCl是否已被洗涤除尽,需进行的操作和现象是,有关反应的离子方程式是。
下列物质转化路线符合工业生产实际的是( )
A .  B . 淀粉
B . 淀粉  C .
C .  D . 饱和NaCl溶液
D . 饱和NaCl溶液  NaHCO3晶体
NaHCO3晶体
 B . 淀粉
B . 淀粉  C .
C .  D . 饱和NaCl溶液
D . 饱和NaCl溶液  NaHCO3晶体
NaHCO3晶体
侯德榜创造性地提出了联合制碱法,其流程如图,下列叙述错误的是( )
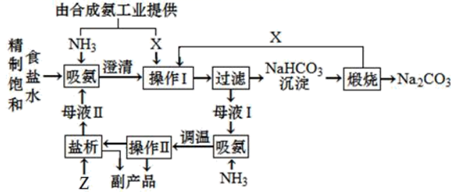
A . 反应原理为Na++NH3+H2O+CO2=NH  +NaHCO3↓
B . X是CO2 , 副产品是NH4Cl
C . 操作Ⅱ采用蒸发结晶分离出副产品
D . “盐析”中加入的Z是NaCl
+NaHCO3↓
B . X是CO2 , 副产品是NH4Cl
C . 操作Ⅱ采用蒸发结晶分离出副产品
D . “盐析”中加入的Z是NaCl
 +NaHCO3↓
B . X是CO2 , 副产品是NH4Cl
C . 操作Ⅱ采用蒸发结晶分离出副产品
D . “盐析”中加入的Z是NaCl
+NaHCO3↓
B . X是CO2 , 副产品是NH4Cl
C . 操作Ⅱ采用蒸发结晶分离出副产品
D . “盐析”中加入的Z是NaCl
X、Y、R是非金属单质,甲、乙、丙、丁、戊是由短周期元素组成的化合物且已在常温下是液体。已知甲、乙相遇产生白烟,0.1mol·L-1的乙溶液的pH=1。上述单质和化合物之间有如图转化关系:

回答下列问题:
-
(1) 实验室中利用丙制取甲的化学方程式为。
-
(2) 侯德榜法制碱时,在甲、戊、已的混合溶液中通入过量CO2 , 反应的化学方程式为;要从溶液中分离出产品,需进行的操作是。
-
(3) 工业上常用甲的浓溶液检测输送R气体的管道是否泄漏,该过程中反应的化学方程式为;若管道泄漏,观察到的现象是。
小组同学探究Na2CO3的性质及工业制法。
-
(1) 用Na2CO3固体配制100mL0.200mol·L−1Na2CO3溶液。
①用到的仪器有:天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和。
②计算需要Na2CO3固体的质量是g。
③下列情况中,会使所配溶液浓度偏高的是(填字母)。
a.转移时,没有洗涤烧杯和玻璃棒
b.定容时,眼睛俯视刻度线
c.摇匀后,发现液面低于刻度线,继续加水至液面与刻度线相切
-
(2) 探究Na2CO3与盐酸的反应。向0.200mol·L−1Na2CO3溶液中滴加稀盐酸,开始无气泡,继续滴加,产生气泡,反应的离子方程式为:
 +H+=
+H+=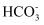 、。
、。
-
(3) 我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献。下图为联合制碱法的主要过程(部分物质已略去)。

已知:i.NH3溶于水生成碱,与酸反应生成盐,如NH3+HNO3=NH4NO3。
ii.有关物质的溶解度(20℃)
物质
NaCl
NH4HCO3
NaHCO3
NH4Cl
溶解度/g
36.0
21.7
9.6
37.2
①煅烧炉中发生的是分解反应,反应的化学方程式为。
②沉淀池中发生的是复分解反应,反应的离子方程式为。
1943年侯德榜发明联合制碱法,其生产流程可简要表示为

已知:NH3极易溶于水生成NH3•H2O,NH3•H2O可电离产生NH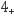 和OH-。下列说法不正确的是( )
和OH-。下列说法不正确的是( )
A . 侯氏制碱法制备NaHCO3利用了物质溶解度差异
B . 流程中先通入CO2再通入NH3可达同样效果
C . 第③步操作是利用了分散质粒子直径大小的不同
D . 母液经过进一步处理可制氮肥
侯德榜(如图)是我国近代著名的化学家,他提出的联合制碱法得到世界各国的认可,其工业流程如图。下列说法错误的是( )

A . 该反应条件下,碳酸氢钠难溶于水
B . 生产时,应先通二氧化碳再通氨气
C . 侯氏制碱法提高了NaCl的利用率
D . 氨气和二氧化碳均来自合成氨工厂
下列图示实验装置(部分夹持装置省略)正确的是( )

A . 图1用于制备并收集少量氨气
B . 图2可吸收多余的HCl气体
C . 图3用标准NaOH溶液测定某醋酸溶液的浓度
D . 图4可用于制备少量NaHCO3
实验室模拟工业上侯德榜制碱原理制备纯碱,下列操作未涉及的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
侯德榜是我国著名爱国科学家,他放弃国外的优厚待遇,毅然回国报效祖国,为我国的化学工业辛勤奋斗了一生。他发明的侯氏制碱法在国际上获奖,振奋了中国人民的志气。侯氏制碱法的工业流程如下图:实验室模拟工业上侯氏制碱原理制备纯碱,下列操作未涉及的是( )
A .  B .
B .  C .
C .  D .
D . 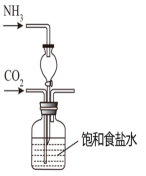
 B .
B .  C .
C .  D .
D . 
最近更新



