纯碱工业(侯氏制碱法) 知识点题库
-
(1) “氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:。
-
(2) 写出“联合制碱法”有关反应的化学方程式:。
-
(3) CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?
-
(4) 绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应列出计原子利用率的表达式:原子利用率(%)?
(1)路布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取、结晶而制得纯碱.
①食盐和浓硫酸反应的化学方程式为 ;
②硫酸钠和焦炭、石灰石反应的化学方程式为 (已知产物之一为CaS);
(2)氨碱法的工艺如图1所示,得到的碳酸氢钠经煅烧生成纯碱.
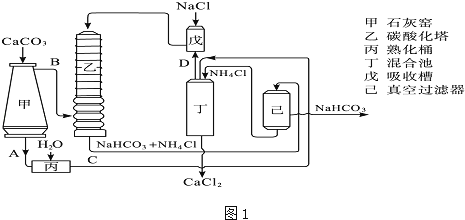
①图中的中间产物C是 ,D是 (写化学式);
②装置乙中发生反应的化学方程式为 ;
(3)联合制碱法是对氨碱法的改进,其优点是 ;
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石等为原料制碳酸钾.请结合如图2的溶解度(S)随温度变化曲线,分析说明是否可行? .
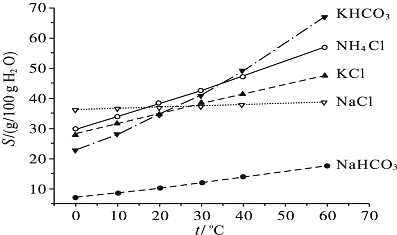
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3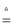 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O

-
(1) 碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号).
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
d.碳酸氢钠的稳定性大于碳酸钠
-
(2) 某活动小组根据上述制碱原理,进行碳酸氢钠的制备实验.
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是 , 其作用是 ;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称),该操作所需要的玻璃仪器有 .
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从a管通入气体,说明原因 .
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 .
-
(3) 碳酸氢钠受热所得固体12.28g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数为 .
-
(4) 请你再设计出一种实验室制取少量碳酸氢钠的方法: .
NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3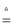 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
回答下列问题:
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号).
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验.
(Ⅰ)一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出).
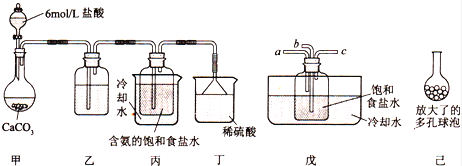
试回答下列有关问题:
①乙装置中的试剂是 .②丁装置的作用是 .
(Ⅱ)另一位同学用图中戊装置(其它装置未画出)进行实验.
①实验时,须先从a管通入 气体(填气体分子式),再从b管通入 气体(填气体分子式).
②有同学建议在戊装置的b管下端连接己装置,理由是 .
(3)“纯碱中常常会混有少量氯化钠.”某研究性学习小组以一包纯碱(只考虑含氯化钠)为研究对象,探究纯碱样品中碳酸钠的含量:称取1.840g小苏打样品(含少量NaCl),配制成250mL溶液,取出25.00mL用0.1000mol•L﹣1盐酸滴定,消耗盐酸21.50mL.
①实验中所需要的定量仪器除滴定管外,还有 .②样品中NaHCO3质量分数为 .
(4)将一定质量小苏打样品(只考虑含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量.若蒸发过程中有少量液体溅出,则测定结果 .(选填“偏高”、“偏低”或“不受影响”)
-
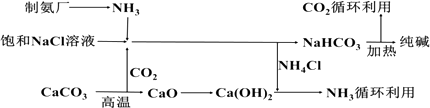
(1) 纯碱是一种重要的化工原料.目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺.
①“氨碱法”产生大量CaCl2副产品,该工艺中生成CaCl2的化学反应方程式为
②“联合制碱法”中相关的化学反应方程式为
③C02是制碱工业的重要原料,请阐述“联合制碱法”与“氨碱法”中C02的来源有何不同
-
(2) 铀(U)是核反应最重要的燃料,在核反应中有重要的应用.目前已经研制成功一种螫合型离子交换树脂,它专门吸附海水中的U4+ , 而不吸附其他元素,其反应原理为 (用离子方程式表示,树脂用HR代替,下同),发生离子交换后的离子交换膜用酸处理还可再生,并得到含铀的溶液,其反应原理为
-
(3) 钢铁工业对促进经济和社会发展起了重要作用.
①不锈钢中含有的铬元素是在炼钢过程的氧吹 (填“前”或“后”)加入.
②炼钢时,加入硅、锰和铝的目的是 .
③炼铁和炼钢生产中,尾气均含有的主要污染物是 ;从环保和经济角度考虑,上述尾气经处理可用作
-
(1) 合成氨工业生产中所用的α﹣Fe催化剂的主要成分是FeO和Fe2O3 , 若某α﹣Fe催化剂中FeO和Fe2O3的物质的量相等,则其中Fe2+与Fe3+的物质的量之比为;
-
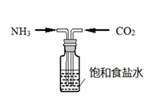
(2) 向饱和NaCl溶液中先通入气体,效果更好.反应制得NaHCO3沉淀和NH4Cl溶液的化学程式为
-
(3) 索尔维制碱法除了得到纯碱外,还会产生一种废渣.侯氏制碱法在此工业上改进,不再使用CaCO3制备CO2 , 而是在制备NH3的过程中制得CO2 , 则侯氏制碱法在得到纯碱的同时还制得了,此物质在农业上的用途是.
-
(1) 工业生产纯碱的第一步是除去饱和食盐水的中Mg2+、Ca2+离子,从成本角度考虑加入试剂的化学式为、.
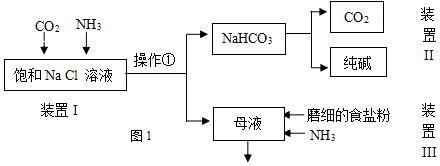
某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如图1:
已知:几种盐的溶解度
NaCl
NH4HCO3
NaHCO3
NH4Cl
溶解度(20℃,100gH2O时)
36.0
21.7
9.6
37.2
-
(2) ①写出装置I中反应的化学方程式.
②从平衡移动角度解释该反应发生的原因.
③操作①的名称是.
-
(3) 写出装置II中发生反应的化学方程式.
-
(4) 请结合化学用语说明装置III中加入磨细的食盐粉及NH3的作用.
-
(5) 该流程中可循环利用的物质是
-
(6) 制出的纯碱中含有杂质NaCl,为测定其纯度,下列方案中不可行的是.
a.向m克纯碱样品中加入足量CaCl2溶液,测生成CaCO3的质量
b.向m克纯碱样品中加入足量稀H2SO4 , 干燥后测生成气体的体积
c.向m克纯碱样品中加入足量AgNO3溶液,测生成沉淀的质量.
 B .
B .  C .
C . 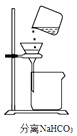 D .
D . 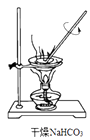
![]()
则下列叙述错误的是( )
 模拟工业制纯碱
B .
模拟工业制纯碱
B . 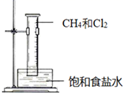 甲烷的取代反应
C .
甲烷的取代反应
C . 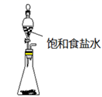 实验室制乙炔
D .
实验室制乙炔
D . 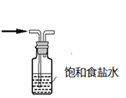 除去氯气中的氯化氢
除去氯气中的氯化氢
-
(1) 侯氏制碱法制得的“碱”的化学式:。
-
(2) 写出碳酸氢钠在水中的电离方程式:。
-
(3) 写出除去
 固体中混有的
固体中混有的  杂质的化学方程式:。
杂质的化学方程式:。
-
(4) 请将方程式补充完整:
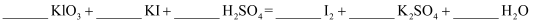
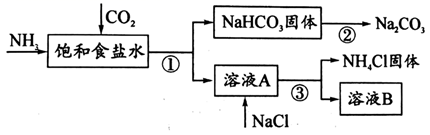
-
(1) ①~③所涉及的操作方法中,包含过滤的是 (填序号)。
-
(2) 根据上图,将化学方程式补充完整: NH3 + CO2 ++ = NaHCO3↓+ NH4Cl
-
(3) 煅烧NaHCO3固体的化学方程式是。
-
(4) 下列说法中,正确的是_____ (填字母)。A . CO2可循环使用 B . NH4Cl副产物可用作肥料 C . 溶液B中一定含有Na+、NH
 、Cl-
、Cl-
-
(5) 同学们将Na2CO3和NaHCO3固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象作出预测:
实验方案
预测现象
预测依据
操作1:向2 mLNa2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液
有白色沉淀
Na2CO3溶液中的CO
 浓度较大,能与CaCl2发生反应(写离子方程式)
浓度较大,能与CaCl2发生反应(写离子方程式)操作2:向2 mLNaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液
无白色沉淀
NaHCO3溶液中的CO
 浓度很小,不能与CaCl2反应
浓度很小,不能与CaCl2反应
 在接触室被氧化为
在接触室被氧化为 ,
,  则在吸收塔用水吸收得到浓硫酸
D . 工业上用焦炭直接还原氧化铁冶炼金属铁
则在吸收塔用水吸收得到浓硫酸
D . 工业上用焦炭直接还原氧化铁冶炼金属铁
 与足量NaOH反应生成
与足量NaOH反应生成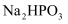 , 则
, 则 为三元酸
B . 工业上利用反应
为三元酸
B . 工业上利用反应 检查氯气管道是否漏气,生成
检查氯气管道是否漏气,生成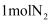 有6mol电子转移
C . 侯氏制碱法实现了对氨气的循环利用
D . 向
有6mol电子转移
C . 侯氏制碱法实现了对氨气的循环利用
D . 向 溶液中通入少量
溶液中通入少量 :
:
N2(g)+3H2(g) 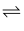 2NH3(g) ΔH=-92.4kJ·mol-1
2NH3(g) ΔH=-92.4kJ·mol-1
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
2NaHCO3  Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
下列有关模拟侯氏制碱法的实验原理和装置正确的是( )
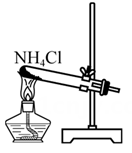 制取NH3
B .
制取NH3
B . 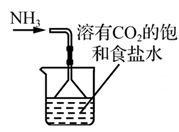 制取NaHCO3
C .
制取NaHCO3
C .  分离NaHCO3
D .
分离NaHCO3
D . 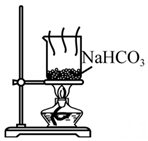 制取Na2CO3
制取Na2CO3
-
(1) 早期人们常用碱液来吸收二氧化碳,生产各类碳酸盐产品。我国科学家侯德榜先生首创的“向饱和NaCl溶液中先后通入过量的氨气和
 制得小苏打和氯化铵,再通过煅烧小。苏打生成纯碱”,称为“侯氏制碱法”。请写出生成小苏打的化学反应方程式。
制得小苏打和氯化铵,再通过煅烧小。苏打生成纯碱”,称为“侯氏制碱法”。请写出生成小苏打的化学反应方程式。
-
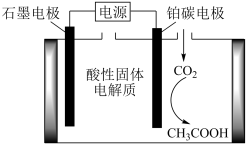
(2) 2021年我国科学家在国际上首先实现了从二氧化碳到淀粉的全人工合成,其原理是利用新型电化学催化装置实现二氧化碳转化为醋酸(如图所示),再经过生物发酵技术转化为淀粉。该装置中阴极的电极反应式为。
-
(3) 我国科学家王亮在
 合成燃料
合成燃料 的催化剂选择方面取得了重大突破,其反应原理如下:
的催化剂选择方面取得了重大突破,其反应原理如下:
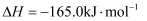 , T℃时,将
, T℃时,将 和
和 充入体积为2L的恒容密闭容器中发生如上反应,10min后反应达到平衡,此时容器内的压强变为起始的
充入体积为2L的恒容密闭容器中发生如上反应,10min后反应达到平衡,此时容器内的压强变为起始的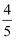 。
。①T℃时,该反应的平衡常数
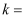 ,0~10min内
,0~10min内 的平均反应速率
的平均反应速率 ;
;②下列情形能表示该反应达到平衡状态的有(填正确答案标号);
A.容器内混合气体的平均摩尔质量不再改变
B.容器内气体的密度不再改变
C.
 的体积分数保持不变
的体积分数保持不变D.
 的值保持不变
的值保持不变E.
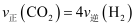
③在T℃时,为了提高
 的转化率可以采取的措施有:等比例增加
的转化率可以采取的措施有:等比例增加 和
和 的物质的量或(任填一种)。
的物质的量或(任填一种)。



