纯碱工业(侯氏制碱法) 知识点题库
-
(1) 卢布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱.
①食盐和浓硫酸反应的化学方程式为 ;
②硫酸钠和焦炭、石灰石反应的化学方程式为 (已知产物之一为CaS);
-
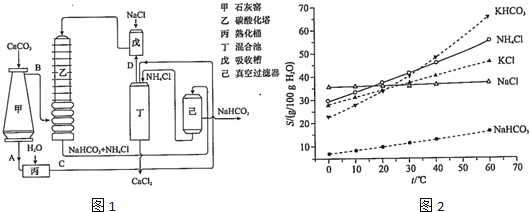
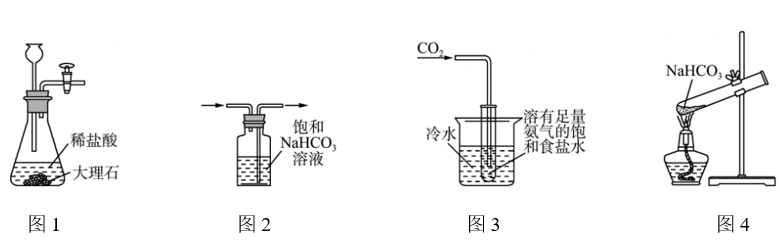
(2) 氨碱法的工艺如图1所示,得到的碳酸氢钠经煅烧生成纯碱.
①图1中的中间产物C是 ,D .(写化学式);
②装置乙中发生反应的化学方程式为 ;
-
(3) 联合制碱法对氨碱法的改进,其优点是 ;
-
(4) 有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾.请结合2图的溶解度(S)随温度变化曲线,分析说明是否可行? .
低温
已知反应I为:NaCl+CO2+NH3+H2O  NaHCO3↓+NH4Cl
NaHCO3↓+NH4Cl
-
(1) 工业生产中,制备NH3的化学方程式是
-
(2) 海水中含有大量的NaCl,以及少量的Ca2+、Mg2+、SO42﹣等离子.
①为得到纯净的饱和NaCl溶液,进行了如下操作.请补全操作步骤:
a.向浓缩后的海水中加入过量的氢氧化钠溶液后,过滤;
b.向滤液中,过滤;
c.向滤液中,过滤;
d.向滤液中加入足量的稀盐酸;
e.加热煮沸一段时间,得到饱和NaCl溶液.
②步骤c中反应的离子方程式是.
-
(3) 反应II的化学方程式是.
-
(4) 制得的纯碱中含有少量NaCl.取5.5g纯碱样品加入足量稀硫酸,得到标准状况下1120mL CO2 . 则样品中纯碱的质量分数是 %(保留1位小数).
已知:①尿素的熔点是132.7℃,常压下超过160℃即可分解;
②三聚氰胺的熔点是354℃,加热易升华,微溶于水;
③以尿素为原料生产三聚氰胺的原理是:6CO(NH2)2  C3N6H6+6NH3+3CO2
C3N6H6+6NH3+3CO2
请回答:
-
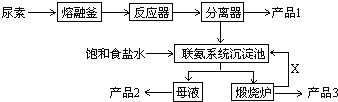
(1) 尿素是一种常用含氮量最高的化肥,其氮元素的质量百分数为,在实验室使其熔化的容器名称叫.
-
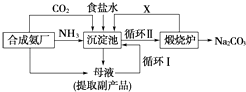
(2) 写出各主要成分的化学式:产品2、X;
-
(3) 联氨系统沉淀池中发生的化学反应方程式为.
-
(4) 工业上合成尿素的化学反应方程式为(反应条件可以不写).
-
(5) 为了使母液中析出更多的产品2,常用的方法是
A.加入固体NaCl B.加入固体NaHCO3 C.通入CO2气体 D.通入NH3
-
(6) 若生产过程中有4%的尿素损耗,每吨尿素可生产三聚氰胺吨.(精确到0.001)
-
(1) 上述生产纯碱的方法称,副产品的一种用途为.
-
(2) 沉淀池中发生反应的化学方程式是.
-
(3) 写出上述流程中X物质的分子式为.
-
(4) 从沉淀池中取出沉淀的操作叫.
-
(5) 为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加.
-
(6) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有.
a.增大NH4+的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3 , 提高析出NH4Cl的纯度.

已知反应I为:NaCl + CO2 + NH3 + H2O = NaHCO3↓+ NH4Cl
-
(1) 工业生产中,制备NH3的化学方程式是。
-
(2) 海水中含有大量的NaCl,以及少量的Ca2+、Mg2+、SO42−等离子。
① 为得到纯净的饱和NaCl溶液,进行了如下操作。请补全操作步骤:
a.向浓缩后的海水中加入过量的氢氧化钠溶液后,过滤;
b.向滤液中,过滤;
c.向滤液中,过滤;
d.向滤液中加入足量的稀盐酸;
e.加热煮沸一段时间,得到饱和NaCl溶液。
② 步骤c中反应的离子方程式是。
-
(3) 反应II的化学方程式是。
-
(4) 制得的纯碱中含有少量NaCl。取5.5 g纯碱样品加入足量稀硫酸,得到标准状况下1120 mL CO2。则样品中纯碱的质量分数是%(保留1位小数)。
-
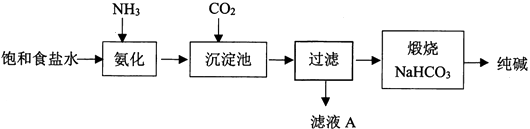
(1) 写出CO2的电子式。
-
(2) 用离子方程式表示纯碱工艺中HCO3-的生成。
-
(3) 工业生产时先氨化再通CO2 , 顺序不能颠倒,原因是。
-
(4) 滤液A中最主要的两种离子是。
-
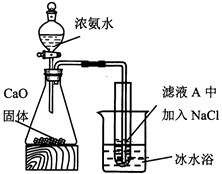
(5) 某小组设计如下实验分离滤液A中的主要物质。打开分液漏斗活塞,一段时间后,试管中有白色晶体生成,用化学原理解释白色晶体产生的原因。
-
(6) 某纯碱样品因煅烧不充分而含少量NaHCO3 , 取质量为m1的纯碱样品,充分加热后质量为m2 , 则此样品中碳酸氢钠的质量分数为。
-
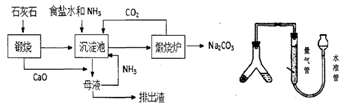
(1) 粗盐中常含Ca2+、Mg2+、SO42-等杂质离子,可依次加入NaOH、、、盐酸试剂来进行提纯。
-
(2) 用化学方程式表示沉淀池中发生的反应为。
-
(3) 氨碱法制得的纯碱样品中可能会含有MgCl2杂质。现用量气法测定纯碱样品的纯度,(如右上图)如何检查该装置的气密性,称取m克样品装入Y型管左侧,量气管中液体应为(填字母)。
A.水
B.饱和食盐水
C.饱和碳酸钠溶液
D.饱和碳酸氢钠溶液
-
(4) 若最后测得产生CO2气体的体积为VL(标况下),则样品中纯碱的纯度为。若最后读数时,发现水准管液面高于量气管(其他操作都正确),则计算所得纯碱样品的纯度值(填“偏大”,“偏小”或“无影响”)。
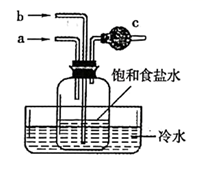
回答下列问题:
-
(1) 从A~E中选择合适的仪器制备NaHCO3 , 正确的连接顺序是(按气流方向,用小写字母表示)。为使A中分液漏斗内的稀盐酸顺利滴下,可将分液漏斗上部的玻璃塞打开或。
A.
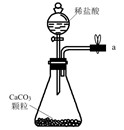 B.
B. 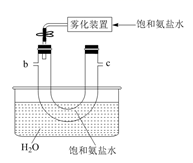 C.
C.  D.
D.  E.
E. 
-
(2) B中使用雾化装置的优点是 。
-
(3) 生成NaHCO3的总反应的化学方程式为。
-
(4) 反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:
①对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2 , Na2O2增重0.14g,则固体NaHCO3的质量为g。
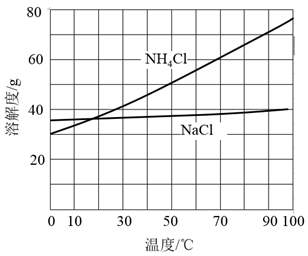
②向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为、、洗涤、干燥。
-
(5) 无水NaHCO3可作为基准物质标定盐酸浓度.称量前,若无水NaHCO3保存不当,吸收了一定量水分,用其标定盐酸浓度时,会使结果___(填标号)。A . 偏高 B . 偏低 不变
 D . “侯氏制碱”:将二氧化碳通入氨化的氯化钠饱和溶液中,析出碳酸钠
D . “侯氏制碱”:将二氧化碳通入氨化的氯化钠饱和溶液中,析出碳酸钠
反应Ⅰ: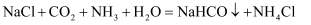
反应Ⅱ: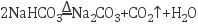
下列制取少量 的实验原理和装置能达到实验目的的是( )
的实验原理和装置能达到实验目的的是( )
 B . 除去
B . 除去 中
中 C . 制取
C . 制取 D . 制取
D . 制取
 D . NaHSO4溶液与Ba(OH)2溶液反应至溶液呈中性:SO
D . NaHSO4溶液与Ba(OH)2溶液反应至溶液呈中性:SO +H++OH-+Ba2+=BaSO4↓+H2O
+H++OH-+Ba2+=BaSO4↓+H2O
气体A的饱和溶液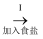 A和食盐的饱和溶液
A和食盐的饱和溶液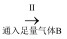 悬浊液
悬浊液 晶体
晶体 纯碱
纯碱
则下列叙述错误的是( )
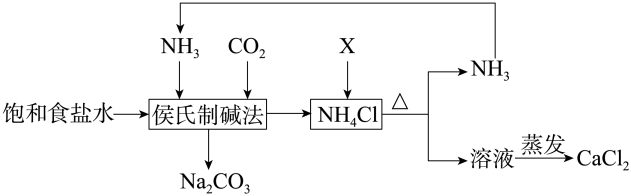
有关该制碱工艺描述错误的是( )
-
(1) I.某化学兴趣小组采用如下图所示装置研究NaHCO3分解的CO2与Na2O2反应。
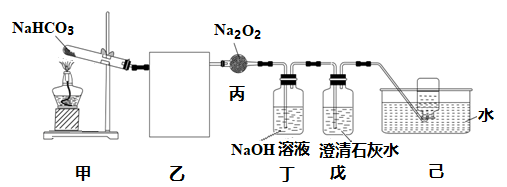
完成下列填空:
画出乙中实验装置图,并标出相应试剂。
-
(2) 装置丙中仪器名称是,其中反应的化学方程式是,该反应中氧化剂与还原剂的质量比为。
-
(3) 装置丁中NaOH溶液的作用是,装置戊中澄清石灰水的作用是。
-
(4) II.NaHCO3俗称小苏打,工业上可由通过侯氏制碱法制取(又称联合制碱法,由我国近代著名的化工学家侯德榜发明)。
写出侯氏制碱法中生成NaHCO3的离子方程式。操作时,往饱和食盐水中先通入气体,原因是。
-
(5) 在密闭容器中投入一定量的Na2O2和NaHCO3 , 在300℃下充分反应。若残留固体为纯净物,则起始时
 应满足的条件是。
应满足的条件是。



