钠的重要化合物 知识点
钠的重要化合物:硫酸钠(Na2SO4·10H2O):俗名:芒硝,为无色晶体。 硫酸钠用途:制玻璃、造纸、染色、纺织、制水玻璃,在医药上用作缓泻剂等。 硫酸钠分布:盐湖、海水及矿物中。
氢氧化钠(NaOH):是中学阶段最为常见的强碱,是一种白色片状晶体,极易溶于水(并放出大量热),易吸水而发生潮解,在空气中还易变质,反应为:2NaOH+CO2=Na2CO3+H2O。 俗名:苛性钠、烧碱、火碱,氢氧化钠有很强的腐蚀性,它是一种重要的碱,具有碱的通性。 工业制法电解饱和食盐水,保存:密封保存。试剂瓶不能用玻璃塞,应用橡皮塞。
碳酸钠(Na2CO3):分子量105.99 。化学品的纯度多在99.5%以上(质量分数),又叫纯碱,但分类属于盐,不属于碱。它是一种重要的有机化工原料,主要用于平板玻璃、玻璃制品和陶瓷釉的生产。还广泛用于生活洗涤、酸类中和以及食品加工等。
碳酸氢钠(NaHCO3):俗称“小苏打”、“苏打粉”、“重曹”,白色细小晶体,在水中的溶解度小于碳酸钠。是一种工业用化学品,可能存在毒性。固体50℃以上开始逐渐分解生成碳酸钠、二氧化碳和水,440℃时完全分解。碳酸氢钠是强碱与弱酸中和后生成的酸式盐,溶于水时呈现弱碱性。此特性可使其作为食品制作过程中的膨松剂。碳酸氢钠在作用后会残留碳酸钠,使用过多会使成品有碱味。
氢氧化钠(NaOH):是中学阶段最为常见的强碱,是一种白色片状晶体,极易溶于水(并放出大量热),易吸水而发生潮解,在空气中还易变质,反应为:2NaOH+CO2=Na2CO3+H2O。 俗名:苛性钠、烧碱、火碱,氢氧化钠有很强的腐蚀性,它是一种重要的碱,具有碱的通性。 工业制法电解饱和食盐水,保存:密封保存。试剂瓶不能用玻璃塞,应用橡皮塞。
碳酸钠(Na2CO3):分子量105.99 。化学品的纯度多在99.5%以上(质量分数),又叫纯碱,但分类属于盐,不属于碱。它是一种重要的有机化工原料,主要用于平板玻璃、玻璃制品和陶瓷釉的生产。还广泛用于生活洗涤、酸类中和以及食品加工等。
碳酸氢钠(NaHCO3):俗称“小苏打”、“苏打粉”、“重曹”,白色细小晶体,在水中的溶解度小于碳酸钠。是一种工业用化学品,可能存在毒性。固体50℃以上开始逐渐分解生成碳酸钠、二氧化碳和水,440℃时完全分解。碳酸氢钠是强碱与弱酸中和后生成的酸式盐,溶于水时呈现弱碱性。此特性可使其作为食品制作过程中的膨松剂。碳酸氢钠在作用后会残留碳酸钠,使用过多会使成品有碱味。
钠的重要化合物 知识点题库
将2mol NaHCO3和一定量的Na2O2固体混合,在加热条件下让其充分反应后得到的固体,经测定Na2O2无剩余,则最后固体的物质的量为( )
A . 1~2mol之间
B . 1~4mol之间
C . 2~4mol之间
D . 大于4mol
下列物质间的转化,通过一步反应不能实现的是( )
A . CO2→Na2CO3
B . FeCl3→FeCl2
C . H2SiO3→Na2SiO3
D . S→SO3
向0.1mol•L﹣1的碳酸钠溶液中通入少量二氧化碳气体时,一定会引起的变化是( )
A . 溶液中的c(CO  )增大
B . 溶液的pH减小
C . 溶液中的c(HCO
)增大
B . 溶液的pH减小
C . 溶液中的c(HCO  )减小
D . 溶液中的c(OH﹣)增大
)减小
D . 溶液中的c(OH﹣)增大
 )增大
B . 溶液的pH减小
C . 溶液中的c(HCO
)增大
B . 溶液的pH减小
C . 溶液中的c(HCO  )减小
D . 溶液中的c(OH﹣)增大
)减小
D . 溶液中的c(OH﹣)增大
下列关于钠及其化合物的说法错误的是( )
A . 钠、过氧化钠、氢氧化钠、碳酸钠灼烧时火焰呈黄色
B . 切开的金属钠暴露在空气中,光亮的表面变暗发生2Na+O2═Na2O2反应
C . 过氧化钠在潮湿空气放一段时间变成白色粘稠物的反应主要是:2Na2O2+2H2O═4NaOH+O2↑
D . 过氧化钠投入硫酸铜溶液可产生氢氧化铜沉淀和氧气
下列物质暴露在空气中易变质的是( )
A . 生石灰
B . 木炭
C . 硫酸钡
D . 氯化钠
下列说法正确的是( )
A . 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液变红
B . 只存在共价键的物质一定是共价化台物、离子化合物中一定含有离子键
C . Na2O与Na2O2组成元素相同、阴阳离子个数比相同,但跟水反应的产物不同
D . 同周期元素原子的最外层电子数越多,得电子能力越强,失电子能力越弱
下列关于碳酸钠和碳酸氢钠的叙述,正确的是( )
A . 常温时,在水中的溶解性:碳酸钠>碳酸氢钠
B . 热稳定性:碳酸钠<碳酸氢钠
C . 质量相同时,分别与同体积同浓度盐酸反应的快慢:碳酸钠>碳酸氢钠
D . 物质的量相同时,分别与足量的盐酸反应,生成CO2的质量:碳酸钠<碳酸氢钠
一团棉花包裹少量过氧化钠放在石棉网上,将CO2气体缓缓通入棉花中的过氧化钠上,棉花很快燃烧起来,实验分析可知,下列表达错误的是( )
A . 反应生成的O2有利于棉花燃烧
B . 过氧化钠与CO2反应放热
C . CO2对棉花燃烧起助燃作用
D . 过氧化钠与CO2反应属于氧化还原反应
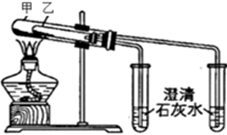
一学生设计入图所示装置进行NaHCO3的分解,并证实产物中有CO2产生。

-
(1) 试管中发生的化学反应方程式是。
-
(2) 指出该学生设计的装置图的错误之处,并改正(文字说明即可)(至少2处)。
-
(3) 烧杯中发生反应的离子方程式是。
-
(4) 如果将16.8gNaHCO3加热一段时间,然后将剩余固体溶于水,并加入足量的CaCl2溶液,最终得到白色沉淀5.0g,则NaHCO3分解百分率为,加CaCl2后反应的离子方程式为。
下列叙述正确的是( )
A . 碳酸氢钠药片,该药是抗酸药,服用时喝些醋能提高药效
B . 将少量钠加入到盛有水和盐酸的烧杯中,可比较水和盐酸中氢的活泼性
C . 钾、钠、镁等活泼金属着火时,可用泡沫灭火剂灭火
D . 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+ , 无K+
下列物质的用途错误的是( )
A . 明矾:净水剂
B . 过氧化钠:供氧剂和漂白剂
C . 碳酸氢钠:胃酸中和剂
D . 生石灰:食品抗氧化剂
关于Na2CO3与NaHCO3的性质判断正确的是( )
A . 常温下,溶解度:Na2CO3<NaHCO3
B . Na2CO3固体中含有少量NaHCO3 , 可用加热法除去
C . 与同浓度同体积的盐酸反应的速率:Na2CO3>NaHCO3
D . 与氯化钙溶液反应,均有白色沉淀生成
下列物质投入溶液中,溶液质量减轻的是( )
A . CaCO3投入到HCl溶液中
B . Na2CO3投入稀硫酸中
C . Fe粉投入CuSO4溶液中
D . Fe粉投入稀HCl溶液中
下列关于实验的说法正确的是( )
A . 钠与氧气在加热条件下反应的实验中,将一小块处理好的金属钠放入坩埚中,开始加热,待钠熔化后停止加热,观察实验现象
B . 氢氧化铁胶体的制备实验,在沸水中滴加饱和氯化铁溶液,继续加热直到液体变为红褐色,停止加热。
C . NaHCO3和Na2CO3的热稳定性比较,通过观察澄清石灰水中的导管口产生气泡的先后来得出结论。
D . NaHCO3和Na2CO3两种固体的鉴别,可以用加少量水,再测定温度的变化来实现,NaHCO3溶于水放热和Na2CO3溶于水吸热。
图中,A为一种中学化学中常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色实验均为黄色。
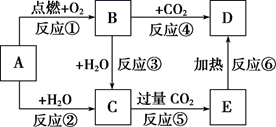
-
(1) 写出A的原子结构示意图,B的化学式。
-
(2) 以上6个反应中属于氧化还原反应的有(填写编号)。
-
(3) 写出B→D反应的化学方程式,C溶液→E反应的离子方程式。
-
(4) 若用所示装置验证D和E的稳定性,则试管乙中装入的固体最好是(填化学式)。
-
(5) 将一定量的B投入到含有下列离子的溶液中:
 、
、  、
、  、Na+ , 反应完毕后,溶液中上述离子数目几乎不变的有(不考虑溶液体积的变化)填离子符号)。
、Na+ , 反应完毕后,溶液中上述离子数目几乎不变的有(不考虑溶液体积的变化)填离子符号)。
下列物质放置在空气中,因发生氧化还原反应而变质的是( )
A . Na2CO3
B . NaCl
C . Na2O2
D . NaOH
某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,B和酸性气体D反应能生成C,A露置在空气中足够长时间也会变为C,E与D反应也能生成C,A、B都能与水反应生成E。回答下列问题:
-
(1) 写出下列物质的化学式:
A,B ,C,D ,E 。
-
(2) 写出下列反应的化学方程式(③写出离子方程式):
①A生成B: ;
②B与水反应生成E:;
③向C的溶液中通入足量的酸性气体D的离子方程式:。
化学与人类生活、生产密切相关。请根据题意填空:
-
(1) 钠有多种化合物,其中俗称“纯碱”的是(填“Na2CO3”或“Na2SO4”)。
-
(2) 矿物能源是现代人类社会赖以生存的重要物质基础。目前,全球仍主要处于化石能源时期。属于化石能源的是(填“石油”或“生物质能”)。
-
(3) 炒菜时加入酒和醋能使菜味香可口,原因是酒和醋反应生成了(填“酯”或“盐”)。
纯碱( )是重要的基础化工原料,我国化学家侯德榜在1943年提出了著名侯氏制碱法。原理为:将
)是重要的基础化工原料,我国化学家侯德榜在1943年提出了著名侯氏制碱法。原理为:将 通入氨化的饱和食盐水中析出
通入氨化的饱和食盐水中析出 晶体,将得到的
晶体,将得到的 晶体加热分解生成
晶体加热分解生成 。下列物质的性质与用途具有对应关系的是( )
。下列物质的性质与用途具有对应关系的是( )
 )是重要的基础化工原料,我国化学家侯德榜在1943年提出了著名侯氏制碱法。原理为:将
)是重要的基础化工原料,我国化学家侯德榜在1943年提出了著名侯氏制碱法。原理为:将 通入氨化的饱和食盐水中析出
通入氨化的饱和食盐水中析出 晶体,将得到的
晶体,将得到的 晶体加热分解生成
晶体加热分解生成 。下列物质的性质与用途具有对应关系的是( )
。下列物质的性质与用途具有对应关系的是( )
A . NaCl晶体熔点高;电解熔融NaCl制取金属Na
B .  水溶液有酸性;氯铵用作农作物肥料
C .
水溶液有酸性;氯铵用作农作物肥料
C .  水溶液有碱性;纯碱用于清洗餐具油污
D .
水溶液有碱性;纯碱用于清洗餐具油污
D .  受热易分解;小苏打用于制作灭火剂
受热易分解;小苏打用于制作灭火剂
 水溶液有酸性;氯铵用作农作物肥料
C .
水溶液有酸性;氯铵用作农作物肥料
C .  水溶液有碱性;纯碱用于清洗餐具油污
D .
水溶液有碱性;纯碱用于清洗餐具油污
D .  受热易分解;小苏打用于制作灭火剂
受热易分解;小苏打用于制作灭火剂
下列有关说法错误的是( )
A . 常温下,干燥的氯气可用钢瓶储运
B . 过氧化钠可用作供氧剂
C . 液氯、氯气不是同种物质
D . 碳酸钠可用于纺织业
最近更新



