й’ зҡ„йҮҚиҰҒеҢ–еҗҲзү© зҹҘиҜҶзӮ№йўҳеә“
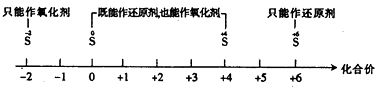 B . еҲҶж•Јзі»зҡ„еҲҶзұ»пјҡ
B . еҲҶж•Јзі»зҡ„еҲҶзұ»пјҡ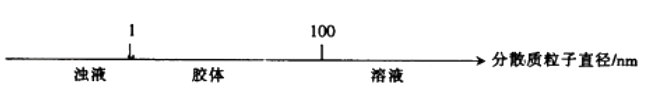 C . AlCl3жә¶ж¶ІдёҺNaOHжә¶ж¶ІеҸҚеә”еҗҺй“қе…ғзҙ зҡ„еӯҳеңЁеҪўејҸпјҡ
C . AlCl3жә¶ж¶ІдёҺNaOHжә¶ж¶ІеҸҚеә”еҗҺй“қе…ғзҙ зҡ„еӯҳеңЁеҪўејҸпјҡ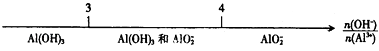 D . CO2дёҺNaOHжә¶ж¶ІеҸҚеә”еҗҺзҡ„дә§зү©
D . CO2дёҺNaOHжә¶ж¶ІеҸҚеә”еҗҺзҡ„дә§зү© Si+2CO иҜҙжҳҺзўізҡ„йқһйҮ‘еұһжҖ§еӨ§дәҺзЎ…зҡ„йқһйҮ‘еұһжҖ§
C . еҗ‘NaAlO2жә¶ж¶Ідёӯж»ҙеҠ йҘұе’ҢNaHCO3жә¶ж¶ІпјҢжңүзҷҪиүІжІүж·Җдә§з”ҹпјҢжҳҜеӣ дёәдёӨиҖ…йғҪеҸ‘з”ҹдәҶж°ҙи§ЈеҸҚеә”пјҢдё”зӣёдә’дҝғиҝӣ
D . е°ҶCO2йҖҡе…ҘNa2SiO3жә¶ж¶ІдёӯпјҢжңүзҷҪиүІжІүж·Җз”ҹжҲҗпјҢиҜҒжҳҺH2CO3й…ёжҖ§жҜ”H2SiO3ејә
Si+2CO иҜҙжҳҺзўізҡ„йқһйҮ‘еұһжҖ§еӨ§дәҺзЎ…зҡ„йқһйҮ‘еұһжҖ§
C . еҗ‘NaAlO2жә¶ж¶Ідёӯж»ҙеҠ йҘұе’ҢNaHCO3жә¶ж¶ІпјҢжңүзҷҪиүІжІүж·Җдә§з”ҹпјҢжҳҜеӣ дёәдёӨиҖ…йғҪеҸ‘з”ҹдәҶж°ҙи§ЈеҸҚеә”пјҢдё”зӣёдә’дҝғиҝӣ
D . е°ҶCO2йҖҡе…ҘNa2SiO3жә¶ж¶ІдёӯпјҢжңүзҷҪиүІжІүж·Җз”ҹжҲҗпјҢиҜҒжҳҺH2CO3й…ёжҖ§жҜ”H2SiO3ејә
-
пјҲ1пјү е®һйӘҢе®Өз”Ёй’ е’ҢзЎ«й…ёй“ңжә¶ж¶ІеҸҚеә”пјҢжңүе…іеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸжңүпјҡпјҢпјӣ
-
пјҲ2пјү иЎЁйқўйҷ„жңүж°§еҢ–иҶңпјҲжҲҗеҲҶжҳҜMgOпјүзҡ„й•ҒжқЎж”ҫе…ҘзЁҖзЎ«й…ёдёӯпјҢејҖе§ӢеҸҚеә”ж—¶зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜпјҡпјӣ
еҸҚеә”зүҮеҲ»еҗҺпјҢеҸҜи§ӮеҜҹеҲ°жңүж°”дҪ“дә§з”ҹпјҢе…¶зҰ»еӯҗж–№зЁӢејҸжҳҜпјҡпјҺ
-
пјҲ3пјү з”Ёе°ҸиӢҸжү“зүҮпјҲNaHCO3пјүжІ»з–—иғғй…ёпјҲ0.2%пҪһ0.4%зҡ„зӣҗй…ёпјүиҝҮеӨҡзҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҡпјҺ
-
пјҲ4пјү зңӢеӣҫеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
еӣҫдёӯдёҚдјҡдә§з”ҹж°”дҪ“зҡ„жҳҜпјҲеЎ«зј–еҸ·пјүпјҢеҶҷеҮәDдёӯеҸ‘з”ҹеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡпјҺ
-
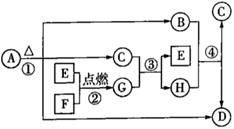
пјҲ1пјү иӢҘAгҖҒBгҖҒCеқҮдёәеҗ«жңүеҗҢз§ҚйқһйҮ‘еұһе…ғзҙ зҡ„еҢ–еҗҲзү©пјҢAдёәдҪҝж№ҝж¶Ұзҡ„зәўиүІзҹіи•ҠиҜ•зәёеҸҳи“қзҡ„ж°”дҪ“пјҢBжҺҘи§Ұз©әж°”з«ӢеҲ»еҸҳдёәCпјҢеҲҷеҸҚеә”в‘ зҡ„еҢ–еӯҰж–№зЁӢејҸдёәгҖӮ
-
пјҲ2пјү иӢҘAгҖҒBгҖҒCдёәз„°иүІеҸҚеә”еқҮе‘Ҳй»„иүІзҡ„еҢ–еҗҲзү©пјҢXдёәж— иүІж— е‘іж°”дҪ“пјҢеҲҷеҸҚеә”в‘Ўзҡ„зҰ»еӯҗж–№зЁӢејҸдёәгҖӮ
-
пјҲ3пјү иӢҘAгҖҒBгҖҒCеқҮдёәеҗ«жңүеҗҢз§ҚйҮ‘еұһе…ғзҙ зҡ„еҢ–еҗҲзү©пјҢXжҳҜејәзўұпјҢеҲҷеҸҚеә”в‘Ўзҡ„зҰ»еӯҗж–№зЁӢејҸдёәгҖӮ
-
пјҲ4пјү иӢҘAдёәеҚ•иҙЁFeпјҢXдёәзЁҖзЎқй…ёпјҢиӢҘеҗ‘Bзҡ„жә¶ж¶ІдёӯеҠ е…Ҙж°ўж°§еҢ–й’ жә¶ж¶ІпјҢзҺ°иұЎдёәгҖӮ
-
пјҲ5пјү иӢҘAе’ҢXеқҮдёәеҚ•иҙЁпјҢBдёәеҸҜдҪҝе“Ғзәўжә¶ж¶ІиӨӘиүІзҡ„ж°”дҪ“пјҢеҲҷеҸҚеә”в‘Ўзҡ„еҢ–еӯҰж–№зЁӢејҸдёәгҖӮ
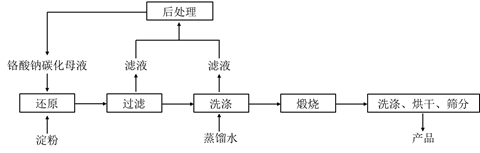
е·ІзҹҘпјҡв‘ еҗ‘еҗ«е°‘йҮҸNa2CO3зҡ„й“¬й…ёй’ зўұжҖ§жә¶ж¶ІдёӯйҖҡе…ҘCO2еҸҜеҲ¶еҫ—дёҚеҗҢзўіеҢ–зҺҮзҡ„й“¬й…ёй’ зўіеҢ–жҜҚж¶Іпјӣ
в‘ЎвҖңиҝҳеҺҹвҖқеҸҚеә”еү§зғҲж”ҫзғӯпјҢеҸҜеҲ¶еҫ—CrпјҲOHпјү3жөҶж–ҷгҖӮ
-
пјҲ1пјү иҜҘе·ҘиүәдёӯвҖңиҝҳеҺҹвҖқеҸҚеә”жңҖеҲқдҪҝз”Ёзҡ„жҳҜи”—зі–жҲ–з”ІйҶӣпјҢеҗҺжқҘж”№з”Ёд»·ж јдҪҺе»үзҡ„ж·ҖзІүгҖӮиҜ·еҶҷеҮәз”ІйҶӣпјҲHCHOпјүдёҺй“¬й…ёй’ пјҲNa2CrO4пјүжә¶ж¶ІеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸгҖӮ
-
пјҲ2пјү е°Ҷж··еҗҲеқҮеҢҖзҡ„ж–ҷж¶ІеҠ е…ҘеҸҚеә”йҮңпјҢеҜҶй—ӯжҗ…жӢҢпјҢжҒ’жё©еҸ‘з”ҹвҖңиҝҳеҺҹвҖқеҸҚеә”пјҢдёӢеҲ—жңүе…іиҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲеЎ«ж ҮеҸ·пјүгҖӮ
A иҜҘеҸҚеә”дёҖе®ҡж— йңҖеҠ зғӯеҚіеҸҜиҝӣиЎҢ B еҝ…иҰҒж—¶еҸҜдҪҝз”ЁеҶ·еҚҙж°ҙиҝӣиЎҢжё©еәҰжҺ§еҲ¶
C й“¬й…ёй’ еҸҜйҖӮеҪ“иҝҮйҮҸпјҢдҪҝж·ҖзІүе……еҲҶеҸҚеә” D еә”е»әйҖ еәҹж°ҙеӣһ收жұ пјҢеӣһ收еҗ«й“¬еәҹж°ҙ
-
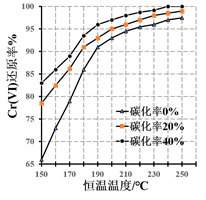
пјҲ3пјү жөӢеҫ—еҸҚеә”е®ҢжҲҗеҗҺеңЁдёҚеҗҢжҒ’жё©жё©еәҰгҖҒдёҚеҗҢзўіеҢ–зҺҮдёӢCrпјҲв…ҘпјүиҝҳеҺҹзҺҮеҰӮдёӢеӣҫгҖӮе®һйҷ…з”ҹдә§иҝҮзЁӢдёӯCrпјҲв…ҘпјүиҝҳеҺҹзҺҮеҸҜй«ҳиҫҫ99.5%д»ҘдёҠпјҢвҖңиҝҳеҺҹвҖқйҳ¶ж®өйҮҮз”Ёзҡ„жңҖдҪіеҸҚеә”жқЎд»¶дёәгҖӮ
-
пјҲ4пјү ж»Өж¶ІдёӯжүҖеҗ«жә¶иҙЁдёәгҖӮиҜҘж°ҙзғӯжі•еҲ¶еӨҮж°§еҢ–铬з»ҝе·Ҙиүәзҡ„дјҳзӮ№жңүгҖҒпјҲиҜ·еҶҷеҮәдёӨжқЎпјүгҖӮ
-
пјҲ5пјү з”ұж°ҙзғӯжі•еҲ¶еӨҮзҡ„ж°ўж°§еҢ–铬дёәж— е®ҡеһӢж°ўж°§еҢ–铬[CrпјҲOHпјү3В·nH2O]гҖӮе°Ҷжҙ—ж¶Ө并干зҮҘеҗҺзҡ„ж°ўж°§еҢ–铬ж»ӨйҘје……еҲҶз……зғ§пјҢиҙЁйҮҸжҚҹеӨұдёҺеӣәдҪ“ж®Ӣз•ҷиҙЁйҮҸжҜ”дёә9:19пјҢз»Ҹи®Ўз®—еҫ—еҮәn=гҖӮ
-
пјҲ6пјү йҮҚй“¬й…ёй’ пјҲNa2Cr2O7В·H2OпјүдёҺзЎ«й…ёй“өзғӯеҲҶи§Јжі•д№ҹжҳҜдёҖз§Қз”ҹдә§ж°§еҢ–铬з»ҝзҡ„ж–№жі•пјҢз”ҹдә§иҝҮзЁӢдёӯдә§з”ҹзҡ„ж°”дҪ“еҜ№зҺҜеўғж— е®іпјҢе…¶еҢ–еӯҰеҸҚеә”ж–№зЁӢејҸдёәгҖӮ
в‘ з”Ёе°ҸиӢҸжү“еҸҜз”ЁдәҺжІ»з–—иғғй…ёиҝҮеӨҡ в‘ЎSO2зҡ„ж°ҙжә¶ж¶ІиғҪеҜјз”өпјҢжүҖд»ҘSO2жҳҜз”өи§ЈиҙЁ в‘ўж¶ІжҖҒHClдёҚеҜјз”өпјҢжүҖд»ҘHClжҳҜйқһз”өи§ЈиҙЁ в‘ЈзЎ«й…ёж°ўй’ з”өзҰ»еҮәзҡ„йҳізҰ»еӯҗжңүж°ўзҰ»еӯҗпјҢжүҖд»ҘзЎ«й…ёж°ўй’ жҳҜй…ё в‘ӨеҲ¶еӨҮFe(OH)3иғ¶дҪ“пјҢйҖҡеёёжҳҜе°ҶйҘұе’Ңж°ҜеҢ–й“Ғжә¶ж¶ІдёҺж°ўж°§еҢ–й’ жә¶ж¶Іж··еҗҲеҠ зғӯ в‘Ҙжҹҗжә¶ж¶ІдёӯеҠ е…Ҙзӣҗй…ёдә§з”ҹдҪҝжҫ„жё…зҹізҒ°ж°ҙеҸҳжө‘жөҠзҡ„ж°”дҪ“пјҢеҲҷдёҖе®ҡеҗ«жңүCO32-
-
пјҲ1пјү Gзҡ„еҢ–еӯҰејҸдёәпјҢGдёӯйҳҙгҖҒйҳізҰ»еӯҗдёӘж•°жҜ”дёәпјҢжҜҸз”ҹжҲҗ1 mol GиҪ¬з§»з”өеӯҗзҡ„зү©иҙЁзҡ„йҮҸдёәгҖӮ
-
пјҲ2пјү AгҖҒDзҡ„ж°ҙжә¶ж¶ІеқҮе‘Ҳ(еЎ«вҖңй…ёжҖ§вҖқвҖңзўұжҖ§вҖқжҲ–вҖңдёӯжҖ§вҖқ)гҖӮеҸҚеә”в‘ в‘Ўв‘ўв‘ЈдёӯеұһдәҺж°§еҢ–иҝҳеҺҹеҸҚеә”зҡ„жңүдёӘгҖӮAпҪһHдёӯз„°иүІе‘Ҳй»„иүІзҡ„зү©иҙЁжңүз§ҚгҖӮ
-
пјҲ3пјү еҶҷеҮәдёӢеҲ—еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸгҖӮ
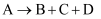 пјҡпјҢ
пјҡпјҢ 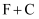 пјҡгҖӮ
пјҡгҖӮ
-
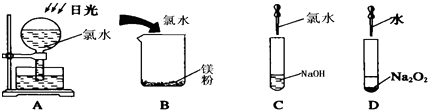
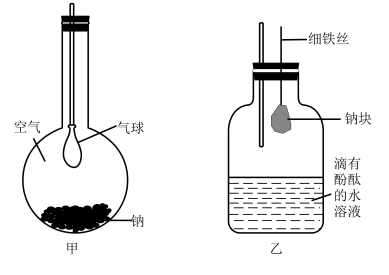
пјҲ1пјү е°ҶдёҖе°Ҹеқ—ж–°еҲҮзҡ„йҮ‘еұһй’ иҝ…йҖҹж”ҫе…Ҙе№іеә•зғ§з“¶еә•йғЁжҢүеӣҫз”ІжүҖзӨәеЎһзҙ§з“¶еЎһгҖӮдёҖж®өж—¶й—ҙеҗҺеҸҜи§ӮеҜҹеҲ°зҡ„зҺ°иұЎжңүпјҢеҸ‘з”ҹеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәгҖӮ
-
пјҲ2пјү жҢүеӣҫд№ҷжүҖзӨәзҡ„иЈ…зҪ®пјҢиҝӣиЎҢй’ дёҺж°ҙеҸҚеә”зҡ„е®һйӘҢпјҢе®һйӘҢејҖе§Ӣж—¶пјҢжҢҜеҠЁз»Ҷй“ҒдёқдҪҝй’ еқ—жҺүе…Ҙж»ҙжңүй…ҡй…һзҡ„ж°ҙжә¶ж¶ІдёӯпјҢеҸҜи§ӮеҜҹеҲ°й’ дёҺж°ҙеҸҚеә”зҡ„зҺ°иұЎпјҢдёҚеҗҢзҡ„зҺ°иұЎеҸҚжҳ й’ зҡ„дёҚеҗҢжҖ§иҙЁгҖӮ
в‘ иғҪиҜҒжҳҺй’ зҡ„еҜҶеәҰжҜ”ж°ҙзҡ„е°Ҹзҡ„зҺ°иұЎжҳҜгҖӮ
в‘ЎиғҪиҜҒжҳҺй’ зҡ„зҶ”зӮ№дҪҺзҡ„зҺ°иұЎжҳҜгҖӮ
в‘ўиғҪиҜҒжҳҺжңүж°ўж°§еҢ–й’ з”ҹжҲҗзҡ„зҺ°иұЎжҳҜгҖӮ
-
пјҲ3пјү е°‘йҮҸ
 дёҺ
дёҺ жә¶ж¶ІеҸҜеҸ‘з”ҹеҸҚеә”пјҢе…¶еҢ–еӯҰж–№зЁӢејҸдёә
жә¶ж¶ІеҸҜеҸ‘з”ҹеҸҚеә”пјҢе…¶еҢ–еӯҰж–№зЁӢејҸдёә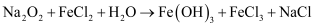 (жңӘй…Қе№і)гҖӮе·ІзҹҘ
(жңӘй…Қе№і)гҖӮе·ІзҹҘ зҡ„еҢ–еӯҰи®ЎйҮҸж•°дёә6й…Қе№ідёҠиҝ°еҢ–еӯҰж–№зЁӢејҸпјҢ并用еҚ•зәҝжЎҘжі•ж ҮеҮәз”өеӯҗиҪ¬з§»зҡ„ж–№еҗ‘е’Ңж•°зӣ®пјҡгҖӮиҜҘеҸҚеә”дёӯиў«иҝҳеҺҹзҡ„е…ғзҙ жҳҜ(еЎ«е…ғзҙ з¬ҰеҸ·)пјҢж°§еҢ–дә§зү©жҳҜ(еЎ«еҢ–еӯҰејҸ)гҖӮ
зҡ„еҢ–еӯҰи®ЎйҮҸж•°дёә6й…Қе№ідёҠиҝ°еҢ–еӯҰж–№зЁӢејҸпјҢ并用еҚ•зәҝжЎҘжі•ж ҮеҮәз”өеӯҗиҪ¬з§»зҡ„ж–№еҗ‘е’Ңж•°зӣ®пјҡгҖӮиҜҘеҸҚеә”дёӯиў«иҝҳеҺҹзҡ„е…ғзҙ жҳҜ(еЎ«е…ғзҙ з¬ҰеҸ·)пјҢж°§еҢ–дә§зү©жҳҜ(еЎ«еҢ–еӯҰејҸ)гҖӮ
-
пјҲ4пјү еҗ‘
 дёӯж»ҙеҠ жө“зӣҗй…ёиҜ•з®ЎеЈҒеҸ‘зғӯпјҢжңүеҲәжҝҖжҖ§ж°”е‘ізҡ„ж°”дҪ“дә§з”ҹпјҢеҸҚеә”еҗҺжүҖеҫ—жә¶ж¶Іе‘Ҳжө…й»„з»ҝиүІгҖӮжҺЁжөӢдә§з”ҹиҜҘж°”дҪ“зҡ„еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәгҖӮ
дёӯж»ҙеҠ жө“зӣҗй…ёиҜ•з®ЎеЈҒеҸ‘зғӯпјҢжңүеҲәжҝҖжҖ§ж°”е‘ізҡ„ж°”дҪ“дә§з”ҹпјҢеҸҚеә”еҗҺжүҖеҫ—жә¶ж¶Іе‘Ҳжө…й»„з»ҝиүІгҖӮжҺЁжөӢдә§з”ҹиҜҘж°”дҪ“зҡ„еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәгҖӮ



