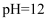钠的重要化合物 知识点题库
①W  X+CO2+H2O;
X+CO2+H2O;
②Z+CO2→X+O2;
③Z+H2O→Y+O2↑;
④X+Ca(OH)2→Y+CaCO3↓.
问题:
-
(1) 则X的俗名是,Z中阴阳离子个数之比为
-
(2) 写出反应③离子方程式:
-
(3) 写出Ca(OH)2与过量W反应化学方程式:
-
(4) 在体积和温度不变的密闭容器中,加入一定量的Z和一定量的CO2充分反应,测得反应前后压强之比为5:4,则反应后容器中CO2和O2物质的量之比为.
-
(1) NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为.
-
(2) Fe2O3是主氧化剂,与Na反应生成的还原产物为(已知该反应为置换反应).
-
(3) KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O,KClO4含有化学键的类型为,K的原子结构示意图为
-
(4) NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为.
-
(5) 100g上述产气药剂产生的气体通过碱石灰后得到N233.6L(标准状况).
①用碱石灰除去的物质为;
②该产气药剂中NaN3的质量分数为.
-
(1) 常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如表;
溶质
CH3COONa
NaHCO3
Na2CO3
NaClO
NaCN
pH
8.8
9.7
11.6
10.3
11.1
上述盐溶液中的阴离子,结合氢离子能力最强的是;根据表中数据,浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最大的是 (填序号).
A . HCN B . HClO C . CH3COOH D . H2CO3 -
(2) 有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:(填“>”“=”“<”下同);溶液中阴离子的物质的量浓度之和:
-
(3) 碳酸氢钠是一种(填“强”或“弱”)电解质;常温下,0.1mol/L碳酸氢钠溶液的pH大于8,试用离子方程式表达其原因,该溶液中Na+、HCO3﹣、H2CO3、CO32﹣、OH﹣五种微粒浓度由大到小的顺序为:.
-
(4) 实验室中常用氢氧化钠来进行洗气和提纯.
①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为:
②几种离子开始沉淀时的pH下表:
离子
Fe2+
Cu2+
Mg2+
pH
7.6
5.2
10.4
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时,(填离子符号)先沉淀,Ksp[Fe(OH)3]Ksp[Mg(OH)2](填“>”“=”或“<”),要使0.2mol/L硫酸铜溶液中铜离子沉淀较为完全(使铜离子浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为.( Ksp[Cu(OH)2]=2×10﹣20 )
①逐渐减小 ②逐渐增大 ③先逐渐增大,然后减小④先逐渐减小,然后增大.
陈述Ⅰ | 陈述Ⅱ | |
A | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
B | 非金属性:Cl>S | 酸性:HClO3>H2SO4 |
C | 常温下,NaHCO3的溶解度比Na2CO3小 | 向饱和Na2CO3溶液中通入CO2产生沉淀 |
D | 常温下,SO2与氢硫酸和NaOH溶液均可反应 | SO2是两性氧化物 |
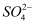 B . 将酸雨试样浓缩后加入Cu和浓H2SO4 , 试管口有红棕色气体,逸出说明酸雨中可能含
B . 将酸雨试样浓缩后加入Cu和浓H2SO4 , 试管口有红棕色气体,逸出说明酸雨中可能含 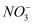 C . 每隔1h测定酸雨试样的pH,其pH先变小后不变,说明刚落下的酸雨中含
C . 每隔1h测定酸雨试样的pH,其pH先变小后不变,说明刚落下的酸雨中含 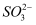 D . 用玻璃棒蘸取酸雨,在酒精灯上灼烧,火焰呈黄色,说明酸雨中一定存在Na+
D . 用玻璃棒蘸取酸雨,在酒精灯上灼烧,火焰呈黄色,说明酸雨中一定存在Na+
 B . NaOH 和
B . NaOH 和  C .
C .  和 HCl
D .
和 HCl
D . 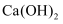 和
和 
 。下列说法合理的是( )
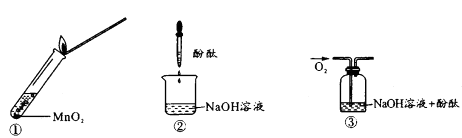
。下列说法合理的是( )序号 | 实验① | 实验② | 实验③ |
实验 |
|
|
|
现象 | 出现白色沉淀 | 无明显现象 | 出现白色沉淀 |
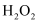 电离得到
电离得到 B . 实验①、②、③证明
B . 实验①、②、③证明 与
与 反应过程中发生反应:
反应过程中发生反应: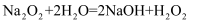 C . 实验①、③生成白色沉淀的反应属于氧化还原反应
D . 可用
C . 实验①、③生成白色沉淀的反应属于氧化还原反应
D . 可用 检验长期放置的
检验长期放置的 中是否含有
中是否含有
 B .
B .  C .
C .  D .
D . 
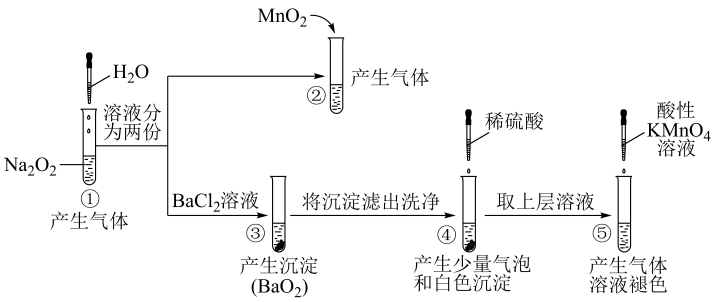
已知:H2O2 H++HO
H++HO ;HO
;HO
 H++O
H++O 。下列分析正确的是( )
。下列分析正确的是( )