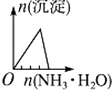镁、铝的重要化合物 知识点题库
|
A |
B |
C |
D |
|
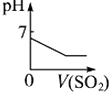
将二氧化硫通入 到一定量氯水中 |
将氨水滴入到一定 量氯化铝溶液中 |
将铜粉加入到 一定量浓硝酸中 |
将铁粉加入到一 定量氯化铁溶液中 |
|
|
|
|
|
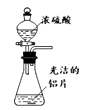 制硫酸铝
B .
制硫酸铝
B . 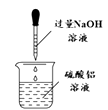 制氢氧化铝
C .
制氢氧化铝
C . 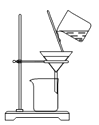 过滤氢氧化铝
D .
过滤氢氧化铝
D . 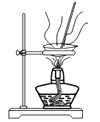 灼烧制氧化铝
灼烧制氧化铝
选项 | X | Y | Z |
A | Al | NaAlO2(aq) | Al(OH)3 |
B | MgO | MgCl2(aq) | Mg |
C | H2O(g) | Fe3O4 | Fe |
D | NaOH(aq) | Na2CO3(aq) | NaHCO3(aq) |
-
(1) 称取样品a g(精确到0.1 g),称量时通常使用的主要仪器的名称是。
-
(2) 将样品溶解于足量的稀盐酸,过滤并洗涤滤渣。滤渣为,溶解、过滤用到的玻璃仪器是。
-
(3) 向滤液中加过量的氢氧化钠溶液,过滤并洗涤滤渣。有关的离子方程式是、。
-
(4) 将步骤(3)中所得的溶液通入过量的CO2,过滤后所得滤渣烘干并灼烧至恒重、冷却后称量,其质量为b g。写出灼烧滤渣的化学方程式是,原样品中铝的质量分数是。
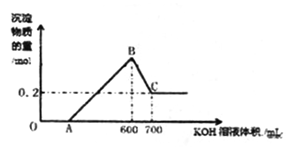
-
(1) OA对应反应的离子方程式为,BC对应反应的离子方程式为;
-
(2) c(KOH)=mol/L,混合物中氧化铝的物质的量为mol;
-
(3) A点对应的数值为;
-
(4) 在中学阶段,实验室里检验B点对应的溶液中的阳离子时,所观察到的现象是。
-
(5) 向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为。
-
(1) 实验室中少量钠通常保存在(填“煤油”或“四氯化碳”)。
-
(2) 铁的一种氯化物俗称“铁红”,用做红色颜料,铁红的化学式是(填“FeO”、”Fe2O3”或“Fe3O4”)
-
(3) Al(OH)3能游溶于盐酸或氢氧化钠溶液,请写出Al(OH)3与氢氧化钠溶液反应的离子方程式:。
已知:①AlCl3、FeCl3分别在183 ℃、315 ℃时升华;②无水AlCl3遇潮湿空气变质。
-
(1) Ⅰ. 实验室可用下列装置制备无水AlCl3。

组装好仪器后,首先应,具体操作为
-
(2) 装置 B中盛放饱和NaCl溶液,该装置的主要作用是。装置C中盛放的试剂是。装置F中试剂的作用是。若用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为
-
(3) 将所制得的无水AlCl3配制溶液时需加入盐酸的目的是
-
(4) Ⅱ. 工业上可由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备,流程如下:

氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为
-
(5) 700 ℃时,升华器中物质充分反应后降温实现FeCl3和AlCl3的分离。温度范围应为
a.低于183 ℃ b .介于183 ℃和315 ℃之间
c.高于315 ℃
-
(6) 样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去)。

计算该样品中AlCl3的质量分数(结果用m、n表示,不必化简)。

 Na2CO3(s)
Na2CO3(s)  NaOH(aq)
B . Al(s)
NaOH(aq)
B . Al(s)  NaAlO2(aq)
NaAlO2(aq)  Al(OH)3(s)
C . AgNO3 (aq)
Al(OH)3(s)
C . AgNO3 (aq)  「Ag(NH3)2」-(aq)
「Ag(NH3)2」-(aq)  Ag(s)
D . Fe2O3(s)
Ag(s)
D . Fe2O3(s)  Fe(s)
Fe(s)  FeCl3(aq)
FeCl3(aq)
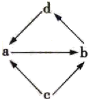
| 编号 | a | b | c | d | |
| ① | Na2O | Na2O2 | Na | NaOH | |
| ② | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
| ③ | FeCl2 | FeCl3 | Fe | CuCl2 | |
| ④ | MgO | MgCl2 | Mg | Mg(OH)2 |
| 选项 | 反应物 | 反应产物或现象 | 影响因素 |
| A | C2H5OH、浓硫酸 | C2H4 或乙醚 | 温度 |
| B | Na、O2 | Na2O 或 Na2O2 | O2 用量 |
| C | Fe、H2SO4 | 有 H2或无 H2 | H2SO4的浓度 |
| D | 氯化铝溶液、氢氧化钠溶液 | 现象不同 | 试剂滴加顺序 |
|
族 周期 |
ⅠA |
0 |
||||||
|
1 |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
||
|
2 |
① |
② |
③ |
|||||
|
3 |
④ |
⑤ |
⑥ |
⑦ |
||||
-
(1) ③号元素在周期表中的位置是;上述元素处于同一主族的有和(用元素符号表示)元素③和④能形成两种化合物,写出其中既含有离子键又含有共价键的化合物是。
-
(2) 元素⑤的氧化物既能与②的最高价氧化物对应的水化物反应,也能和④的最高价氧化物对应的水化物反应,该氧化物是(填化学式),写出该氧化物与④的最高价氧化物对应的水化物反应的离子方程式。
-
(3) 含锂材料在社会中广泛应用,如各种储氢材料(Li2NH等)、便携式电源材料(LiCoO2等)。根据下列要求回答问题:
①
 和
和 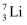 作核反应堆最佳热载体,
作核反应堆最佳热载体,  和
和  用作高温堆减速剂。下列说法正确的是。
用作高温堆减速剂。下列说法正确的是。A.
 和
和 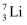 互为同位素
互为同位素B.
 和
和 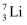 属于同种核素
属于同种核素C.
 和
和  的化学性质不同
的化学性质不同D.
 和
和  是同种物质
是同种物质②下列说法错误的是。
A. 碱性:Be(OH)2<LiOH<NaOH<KOH
B. 微粒半径:K>Na>Li>Li+
C. 氧化性:Li+<Na+<K+<Rb+<Cs+
D. 金属性:Cs>Rb>K>Na>Li>Be
 ,含
,含  和
和  等杂质)为原料制备铝的一种工艺流程如图所示:
等杂质)为原料制备铝的一种工艺流程如图所示: 
注:  在“碱溶”时转化为铝硅酸钠沉淀。
在“碱溶”时转化为铝硅酸钠沉淀。
-
(1) 铝土矿“碱溶”时,氧化铝转化为进入溶液,提高铝土矿浸取速率的措施有(任答两点)。
-
(2) 向“过滤Ⅰ”所得滤液中加入
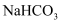 溶液,溶液的pH(填“增大”“减小”或“不变”),发生反应的离子方程式为。
溶液,溶液的pH(填“增大”“减小”或“不变”),发生反应的离子方程式为。
-
(3) “电解Ⅰ”是电解熔融的
 ,标准状况下每产生
,标准状况下每产生 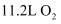 转移的电子数为。
转移的电子数为。
-
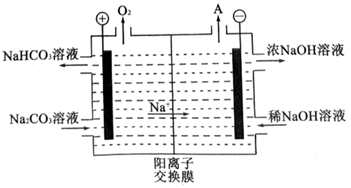
(4) “电解Ⅱ”是电解
 溶液,其原理如图所示,阳极的电极反应式为。
溶液,其原理如图所示,阳极的电极反应式为。