镁、铝的重要化合物 知识点题库

-
(1) 以上设计的两种方案中,合理而又考虑经济效益的是(填编号)。
-
(2) 若提纯时用的原料除铝土矿、水外,还需物质在下列物质中选择:①Na2CO3 , ②CaCO3 , ③H2SO4 , ④HCl,⑤KOH。试写出有关主要反应的化学方程式(是离子反应的要写离子方程式):。
镁是一种很活泼的金属,常用作脱硫剂、脱氧剂.现在,某化学兴趣小组对金属镁的性质进行实验探究.他们首先在网络上查找到了一些关于金属镁的性质的方程式如下:
①2Mg+O2 2MgO;②3Mg+N2
2MgO;②3Mg+N2 Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2 2MgO+C
2MgO+C
④Mg+H2O MgO+H2↑;⑤Mg3N2+6H2O
MgO+H2↑;⑤Mg3N2+6H2O 3Mg(OH)2+2NH3↑
3Mg(OH)2+2NH3↑
完成下列填空:
现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2).实验装置如下(部分夹持仪器省略).
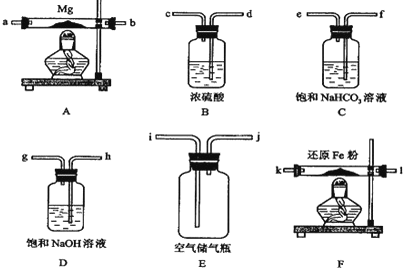
-
(1) 装置F的作用是 .通气后,如果同时点燃A、F装置的酒精灯,对实验结果的影响是 ,产生这一现象的原因是 .
-
(2)
请设计一个实验,验证产物是氮化镁: .
镁在电子工业中利用镁制取硅的反应为:2Mg+SiO2
 2MgO+Si,同时有副反应发生:2Mg+Si
2MgO+Si,同时有副反应发生:2Mg+Si Mg2Si
Mg2SiMg2Si遇盐酸迅速反应生成SiH4(硅烷).SiH4在常温下是一种不稳定、易分解的气体.
-
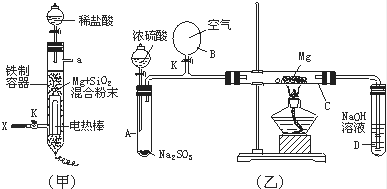
(3) 图(甲)是进行Mg与SiO2反应的实验装置.由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气.X气体应选用①CO2、②N2、③H2中的 (选填编号).实验开始时,必须先通入X的气体,再接通电源加热反应物,其理由是 ;当反应引发后,切断电源,反应能继续进行,其原因是 .
-
(4) 图(乙)所示装置进行的实验如下:先关闭K,使A中反应进行;加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质.实验完成后,将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成.C中的Mg应放在不锈钢垫片上而不能直接接触管壁,这是因为 .停止实验时,先打开K,再停止滴加浓硫酸并熄灭酒精灯.橡胶气胆B在实验中的作用是 .C中全部反应产物有 (填化学式).
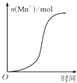 表示10 mL 0.01mol•L﹣1KMnO4酸性溶液与过量的0.1mol•L﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用)
B .
表示10 mL 0.01mol•L﹣1KMnO4酸性溶液与过量的0.1mol•L﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用)
B . 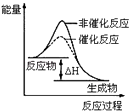 表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C .
表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C .  表示示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系
D .
表示示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系
D .  表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化

根据图示转化关系回答:
-
(1) 写出下列物质的化学式:单质A,乙.
-
(2) 写出单质A与Fe2O3反应的化学方程式:,利用该反应的原理,可用于
-
(3) 用单质A做成的容器可以储存和运输浓硫酸的原因是.
-
(4) 写出反应①的离子方程式:.
-
(5) 工业上冶炼下列物质通常 不采用电解法的是.
a.Na b.Mg c.Fe d.Ag
-
(6) 用铝粉和Fe2O3做铝热反应实验,需要的试剂还有
a.KCl b.KClO 3 c.MnO2 d.Mg.

-
(1) 在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性.
①该过程中涉及某氧化还原反应如下,请完成:□Fe2++□ClO﹣+=□Fe(OH)3↓+□Cl﹣+
②检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象).
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为(填代号).
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、(填操作名称)、洗涤.
-
(2) SiO2和NaOH焙烧制备硅酸钠,可采用的装置为(填代号).

-
(1) I.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时有如下分解反应:2Mg5Al3(OH)19(H2O)4
 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3 除去固体产物中Al2O3的离子方程式为。
-
(2) MgO可溶于NH4Cl溶液的化学方程式为。
-
(3) II.过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体消毒剂。工业生产过程如下: ①在NH4Cl溶液中加入Ca(OH)2 ②不断搅拌的同时加入30% H2O2(弱酸性),生成CaO2•8H2O沉淀 ③经过陈化、过滤、水洗得到CaO2•8H2O,再脱水干燥得到CaO2。
CaO2的电子式为。
-
(4) 可循环使用的物质是。工业生产中常选用过量的反应物是Ca(OH)2而不是H2O2 , 这是因为。
-
(5) 检验CaO2•8H2O是否洗净的操作是。
-
(6) 测定产品中CaO2含量:
取mg样品,与足量稀硫酸反应充分,生成的H2O2用cmol/L的KMnO4溶液滴定,消耗标准液的体积为VmL,则该样品中CaO2质量百分数为(含m、C、V的表达式)。
 Al(OH)3
Al(OH)3 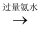 [Al(OH)4 ]-
B . Fe2O3(s)
[Al(OH)4 ]-
B . Fe2O3(s) 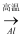 Fe(s)
Fe(s)  FeCl3(aq)
C . NaHCO3(s)
FeCl3(aq)
C . NaHCO3(s)  Na2CO3
Na2CO3  NaOH(aq)
D . Al(s)
NaOH(aq)
D . Al(s)  NaAlO2(aq)
NaAlO2(aq)  Al(OH)3 (s)
Al(OH)3 (s)
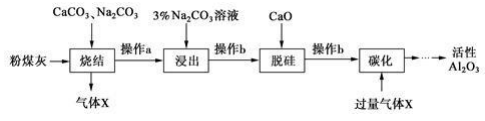
已知烧结过程的产物主要是NaAlO2、Ca2SiO4、NaFeO2和Na2SiO3等。
-
(1) 写出烧结过程中铝元素转化的化学方程式。
-
(2) 操作 a 为冷却、研磨,其中研磨的目的是。
-
(3) ①浸出过程中, NaFeO 2 可完全水解,生成沉淀为。
②3%Na2 CO3溶液显(填 “酸性 ”、 “碱性 ”或“中性 ”),请用离子方程式解释:。
-
(4) 操作b 所用的玻璃仪器有漏斗、、。
-
(5) “碳化”时,通入过量气体 x 主要成分的化学式为。
-
(6) 工业上电解Al2O3制备 Al 是为使Al2O3在较低温下融化,通常加入。电解过程中做阳极的石墨易消耗,原因是。

①Na、Na2O、Na2O2 ②AlCl3、Al(OH)3、 NaAlO2 ③ Fe、 FeCl2、FeCl3 ④NaOH、Na2CO3 、NaHCO3 ⑤C、CO、CO2
-
(1) Ⅰ.为探究无水盐X(仅含5种元素)的组成和性质,设计并完成如下实验:

请回答:
组成X的5种元素符号是H、N;X的化学式是。
-
(2) 写出向X溶液中加入足量的浓Ba(OH)2溶液并微热的离子方程式。
-
(3) 写出检验X中金属阳离子的实验操作和现象:。
-
(4) Ⅱ.钠、镁、铁是重要的金属元素。
隔绝空气条件下,金属Na和Fe2O3粉末高温发生置换反应的化学方程式为:
-
(5) 化合物Mg (OH)2可作环保型阻燃材料,受热时按如下化学方程式分解:Mg (OH) 2
 H2O↑+MgO,该化合物作阻燃剂的可能原因是____________(填序号)
A . 氢氧化镁易升华,降低温度 B . MgO固体覆盖在可燃物表面,隔绝空气 C . 水蒸气稀释空气 D . 生成的水高温分解吸热,降低温度
H2O↑+MgO,该化合物作阻燃剂的可能原因是____________(填序号)
A . 氢氧化镁易升华,降低温度 B . MgO固体覆盖在可燃物表面,隔绝空气 C . 水蒸气稀释空气 D . 生成的水高温分解吸热,降低温度



