镁、铝的重要化合物 知识点题库
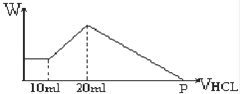
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58克白色沉淀,在所得浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示:
(1)混合物中NaOH的物质的量为 ,
(2)混合物中AlCl3质量为 ,
(3)混合物中MgCl2质量为 ,
(4)P点表示盐酸的体积是 .
下列物质在一定条件下可以转化的是( )
A . CaCl2  CaCO3
CaCO3  CaO
B . Fe
CaO
B . Fe  FeCl2
FeCl2  Fe(OH)2
C . Al2O3
Fe(OH)2
C . Al2O3  NaAlO2
NaAlO2  Al(OH)3
D . SiO2
Al(OH)3
D . SiO2  H2SiO3
H2SiO3  Na2SiO3
Na2SiO3
 CaCO3
CaCO3  CaO
B . Fe
CaO
B . Fe  FeCl2
FeCl2  Fe(OH)2
C . Al2O3
Fe(OH)2
C . Al2O3  NaAlO2
NaAlO2  Al(OH)3
D . SiO2
Al(OH)3
D . SiO2  H2SiO3
H2SiO3  Na2SiO3
Na2SiO3
下列说法中正确的是( )
①锂在空气中燃烧生成的Li2O
②Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒
③盐酸既有氧化性又有还原性
④Fe(OH)3、FeCl2、H2SiO3都不能直接用化合反应制备
⑤SO2能使酸性高锰酸钾溶液褪色,所以它具有漂白性.
A . ②③④
B . ①②③
C . ①③
D . ①②
某氧化物不溶于水,溶于熔化的NaOH中,生成易溶于水的化合物,向稀盐酸中滴加所生成化合物的水溶液,立即有白色沉淀产生,则原氧化物是( )
A . Al2O3
B . MgO
C . SiO2
D . P2O5
含有HCl和AlCl3的混合溶液中加入NaOH溶液,生成的沉淀和加入NaOH溶液的体积关系的图象为( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个化学方程式表示的是( )
A . 稀盐酸,Na2CO3溶液
B . 稀H2SO4溶液,NaAlO2溶液
C . Cl2 , NaBr溶液
D . CO2 , 澄清石灰水
下列变化可通过一步化学反应实现的是( )
A . S→SO3
B . Al2O3→Al(OH)3
C . SiO2→H2SiO3
D . Na2CO3→NaOH
相等物质的量的下列物质,分别与足量NaOH的溶液反应,消耗NaOH物质的量最多的是( )
A . Al2O3
B . KAl(SO4)2
C . Al(OH)3
D . Al
以下物质可以通过化合反应直接制得的是( )
A . Al(OH)3
B . Fe(OH)3
C . Fe(OH)2
D . H2SiO3
下列有关物质的性质与用途具有对应关系的是( )
A . Na2S具有还原性,可用于去除水体中Hg2+
B . O3具有氧化性,可用于自来水的消毒杀菌
C . 葡萄糖易溶于水,可用作制镜工业的原料
D . Al2O3具有两性,可用作耐高温材料
有关Al2O3的叙述正确的是( )
A . 可用于净水
B . 是碱性氧化物
C . 可与水化合成Al(OH)3
D . 可通过铝热反应生成
下列物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( )
A . Na2CO3和盐酸
B . AlCl3和NaOH
C . NaAlO2和硫酸
D . Na2CO3和BaCl2
下列关于铝及其化合物说法,错误的是( )
A . 明矾可用作净水剂和消毒剂
B . 利用铝热反应可冶炼高熔点金属
C . 铝可用作包装材料和建筑材料
D . 氢氧化铝可用作治疗胃酸过多的药物
下列方案设计、现象和结论都正确的是( )
| 目的 | 方案设计 | 现象和结论 | |
| A | 比较金属铝和氧化铝熔点的高低 | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 铝箔熔化但不滴落,说明金属铝的熔点比氧化铝低 |
| B | 检验某牙膏中是否存在甘油 | 取少量该牙膏样品于试管中,加适量蒸馏水,搅拌、静置,取上层清液,加入适量新制氢氧化铜,观察现象 | 若产生绛蓝色沉淀,则该牙膏中含甘油 |
| C | 检验乙醇的消去产物中有乙烯 | 将产生的气体通入酸性高锰酸钾溶液 | 若高锰酸钾褪色,则证明产物中有乙烯 |
| D | 检验Cu2O中是否含有Cu | 取样,加入稀硝酸,观察现象 | 若有气泡产生,则说明样品中有Cu |
A . A
B . B
C . C
D . D
下列有关物质的性质与用途具有对应关系的是( )
A . 钠钾合金的密度小,可用作快中子反应堆的热交换剂
B . Al2O3 的熔点很高,可用作耐火材料
C . Na2SiO3 溶液呈碱性,可用作木材的防火剂
D . FeCl3 溶液具有酸性,可用作铜制线路板的蚀刻剂
氢能是解决化石能源枯竭与环境污染两大问题的理想选择,但安全和高效的储氢技术是目前氢能规模化应用的主要瓶颈。现有某固体化合物X(含有三种短周期元素)是一种络合氢化物储氢材料,某实验员对某固体化合物X作如图实验:
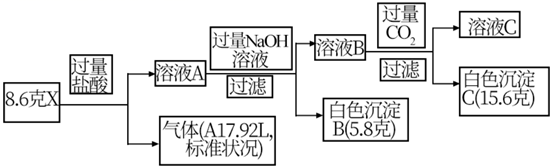
请回答:
-
(1) 化合物X的组成元素。
-
(2) 溶液A中溶质组成:。
-
(3) 试写出溶液B与过量CO2反应的离子方程式。
-
(4) 试写出固体X与过量的NaOH溶液混合反应的化学方程式。
-
(5) 利用如图装置和试剂可以测定生成A气体的体积。

①操作全部正确的条件下测出气体体积与理论值相比(填“偏大”“不变”“偏小”)。
②对实验装置如何改进能较为准确的测量出生产气体的体积。
下列关于铝及其化合物说法,正确的是( )
A . 氧化铝是离子化合物,其晶体中离子键很强,故熔点很高,可用作耐火材料
B . 氢氧化铝胶体可净水,故饮用水中含铝净水剂可长期使用
C . 铝槽车能运送浓硝酸是因为常温下铝与浓硝酸不反应
D . 铝是地壳中含量最高的金属元素,铝以游离态和化合态两种形式存在于地壳中
下列陈述I、II正确且有因果关系的是( )
| 选项 | 陈述I | 陈述II |
| A | Al有强氧化性 | 利用铝热反应冶炼金属Fe、Mn等 |
| B | 氢氧化铝具有弱碱性 | 可用于制胃酸中和剂 |
| C | H2O2、SO2都能使酸性KMnO4褪色 | H2O2表现氧化性,SO2表现还原性 |
| D | 水蒸气通过灼热铁粉,铁粉变红褐色 | 铁粉与水蒸气在高温下发生反应 |
A . A
B . B
C . C
D . D
以高硫铝土矿(主要成分为Al2O3、Fe2O3 , 少量FeS2等)为原料,生产氧化铝并获得 Fe3O4的部分工艺流程如下:
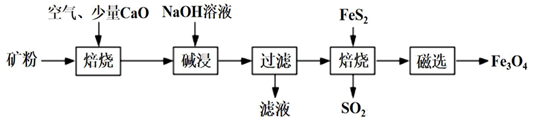
-
(1) 为了提高第一次焙烧后的烧渣在碱浸时的溶出速率,可采取的有效措施为、(任写两点)。
-
(2) 已知:①第一次焙烧的主要目的是脱硫(降低矿粉中硫化物型硫的含量),以免影响产品Al2O3的质量;②此过程中FeS2与氧气发生了氧化还原反应:4FeS2+11O2
 2Fe2O3+8SO2。第一次焙烧结束后,硫最终主要以(填物质的化学式)的形式存在。
2Fe2O3+8SO2。第一次焙烧结束后,硫最终主要以(填物质的化学式)的形式存在。
-
(3) 碱浸时发生的主要反应的离子方程式为。
-
(4) 第二次焙烧过程中产生了污染性气体SO2大量排放,SO2容易造成酸雨等环境问题,工业上可用双碱法脱硫法处理废气,过程如图所示,其中可循环使用的试剂是,写出双碱法脱硫法的总反应方程式:。

-
(5) 纯度检验:将少量磁选后的产品溶于稀硫酸中,再滴入酸性KMnO4溶液,若酸性KMnO4褪色,(填“能”或“不能”)说明产品中含有FeO,理由是。
-
(6) 第二次焙烧是在缺氧的条件下进行的,此步骤发生的主要反应的化学反应方程式为。
下列关于Mg、Fe、Cu的说法正确的是( )
A . 三种金属单质放置在空气中均只生成氧化物
B . 保存Fe2(SO4)3溶液时需要加入铁钉
C . 无需另选试剂就可以鉴别MgSO4、Fe2(SO4)3和CuSO4
D . 三种金属的活泼性:Mg>Cu>Fe
最近更新



