镁、铝的重要化合物 知识点题库
将一定质量的镁铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示.由图中数据计算:

-
(1) 原合金中镁和铝的质量.
-
(2) 盐酸的物质的量浓度.
“铝热反应”的化学方程式为:2Al+Fe2O3 Al2O3+2Fe.某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
Al2O3+2Fe.某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | ﹣﹣ |
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金.这种推测有一定的道理,理由是: .
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是 ,当观察到 现象时,说明熔融物中含有金属铝,反应的离子方程式为 .
(3)实验室溶解该熔融物,最好选用下列试剂中的 (填序号).
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液.
向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是( )
A . c(CO32﹣)
B . c(Mg2+)
C . c(H+)
D . Ksp(MgCO3)
某溶液中含MgCl2和AlCl3各0.01mol,向其中逐滴滴加1mol/L的NaOH溶液至过量,下列关系图正确的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
有一镁、铝合金,在适量稀硫酸中恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠溶液的体积变化如图所示,则合金中镁、铝的物质的量之比为( )

A . 2:1
B . 4:1
C . 1:1
D . 1:2
下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个化学方程式表示的是( )
A . 稀盐酸,Na2CO3溶液
B . 稀H2SO4溶液,NaAlO2溶液
C . Cu,FeCl3溶液
D . 浓氨水,AgNO3溶液
下列各组物质相互混合反应后,最终有白色沉淀生成的是( )
①在敞口容器中将金属钠投入到FeCl2溶液中
②向AlCl3溶液中逐滴加入过量的稀氢氧化钠溶液
③向硅酸钠溶液中逐滴加入过量的盐酸
④向NaAlO2溶液中通入过量CO2
⑤向饱和Na2CO3溶液中通入过量CO2 .
A . ①③④⑤
B . 只有①④
C . 只有②③
D . 只有③④⑤
如图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )

A . NH4Al(SO4)2
B . KAl(SO4)2
C . Al2(SO4)3
D . NaAlO2
如图表示AlCl3溶液与NaoH溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是( )

A . ①线表示Al3+的物质的量的变化
B . x表示AlCl3的物质的量
C . ③线表示Al(OH)3的物质的量的变化
D . ④线表示  的物质的量的变化
的物质的量的变化
 的物质的量的变化
的物质的量的变化
工业上常利用铝粉和氧化铁反应来焊接铁轨.下列说法正确的是( )
A . Al2O3、Fe2O3均为两性氧化物
B . 该反应中化学能全部转化为热能
C . Al2O3中的微粒半径:r(Al3+)>r(O2﹣)
D . 在该反应条件下,Al的还原性强于Fe的还原性
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:

-
(1) 加入NaOH溶液0﹣﹣20mL过程中反应方程式为:.160﹣﹣180mL过程中反应方程式为.
-
(2) 合金中Mg的质量为g.所用HCl的物质的量浓度为mol/L.
将5gAl、Al2O3、Al(OH)3的混合物与200g4.9%的稀硫酸混合,恰好完全反应。将反应后的溶液蒸干后,最终得到固体的质量是( )
A . 11.4g
B . 14.8g
C . 205g
D . 无法计算
工业上从铝土矿(主要成分是Al2O3 , 还含有SiO2、Fe2O3等杂质)中提取铝可使用如下工艺流程:
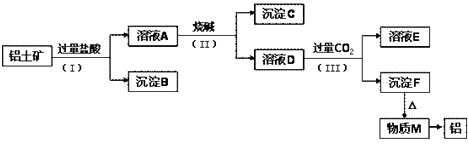
已知:SiO2不溶于水且不与盐酸反应。请回答下列问题:
-
(1) 图中涉及分离溶液与沉淀的实验方法是(填操作名称)。
-
(2) 步骤(Ⅱ)中加入的烧碱溶液应该是(填“少量”或“过量”)。沉淀B的成分是(填化学式,下同);溶液D中含铝元素的溶质的是。
-
(3) ①物质M在生产生活中有重要用途,写出沉淀F转化为物质M的化学方程式:;溶液D中通入CO2生成沉淀F的离子方程式为:。
化学与生活密切相关,下列说法正确的是( )
A . 铝制容器不宜长时间存放酸性食物、碱性食物以及含盐腌制食物
B . 生活中常用热的小苏打除油污,利用的是水解反应吸热的特点
C . Mg可通过电解MgCl2的水溶液来制取,Al可通过电解熔融的Al2O3来制取
D . 用来煎炸食物的花生油和牛油都是可以发生皂化反应的饱和脂肪酸甘油酯
下列说错误的是( )
A . 金属钠有强还原性,能和硫酸铜溶液反应,析出金属铜
B . 用Al(OH)3治疗胃酸过多
C . 过氧化钠可用于呼吸面具中作为氧气的来源
D . 绚丽缤纷的烟花中添加了含钾、钙、钠、铜等金属元素化合物
下列反应能发生并用于化工生产的是( )
A . 制盐酸:Cl2+H2  2HCl
B . 制取镁:MgCl2(溶液)
2HCl
B . 制取镁:MgCl2(溶液)  Mg+Cl2
C . 制乙烯:C2H5OH
Mg+Cl2
C . 制乙烯:C2H5OH 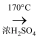 CH2=CH2+H2O
D . 制乙醇:CH2=CH2+H2O
CH2=CH2+H2O
D . 制乙醇:CH2=CH2+H2O 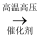 C2H5OH
C2H5OH
 2HCl
B . 制取镁:MgCl2(溶液)
2HCl
B . 制取镁:MgCl2(溶液)  Mg+Cl2
C . 制乙烯:C2H5OH
Mg+Cl2
C . 制乙烯:C2H5OH 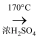 CH2=CH2+H2O
D . 制乙醇:CH2=CH2+H2O
CH2=CH2+H2O
D . 制乙醇:CH2=CH2+H2O 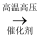 C2H5OH
C2H5OH
从海水晒盐后的母液中提取镁,最基本的方法是往海水中加石灰乳,得到Mg(OH)2沉淀,将沉淀分离后再加入盐酸变成MgCl2溶液;之后经结晶、过滤、干燥、电解,即可得到金属镁(已知镁在热水中能反应生成氢气)。工艺流程如下:

下列对从海水中提取镁的有关说法正确的是( )
A . 电解MgCl2溶液即可得到金属镁
B . 电解后得到的镁应在氮气氛围中冷却
C . 上述从母液中提取镁的变化过程中不存在分解反应
D . 制备过程中产生的氯气可以用来制备盐酸,循环使用
下列固体物质中的杂质(括号内为杂质)能用加热法直接除去的是( )
A . Fe粉(硫粉)
B . Na2CO3粉末(NaHCO3)
C . Al (OH)3(Al2O3)
D . KMnO4(MnO2)
下列各组反应中,所得产物相同的是( )
A . 金属铜与浓硝酸或稀硝酸反应
B . 钠在常温或加热条件与氧气反应
C . 铁在少量氧气或过量的氧气中点燃
D . 氯化铝溶液与少量氢氧化钠溶液或过量氢氧化钠溶液反应
下列“类比”或“对比”不合理的是( )
A . Mg在CO2中点燃反应生成MgO和C,则Ca在CO2中点燃反应生成CaO和C
B . NaClO溶液与CO2反应生成NaHCO3和HClO,而Ca(ClO)2溶液与少量CO2反应生成CaCO3和HClO
C . Na3N与盐酸反应生成NaCl和NH4Cl,则Mg3N2与盐酸反应生成MgCl2和NH4Cl
D . NaOH溶液与少量AgNO3溶液反应生成Ag2O和NaNO3 , 则氨水与少量AgNO3溶液反应最终生成Ag2O和NH4NO3
最近更新



