探究碳酸钠与碳酸氢钠的性质 知识点题库
不能用来鉴别Na2CO3和NaHCO3的方法是( )
A . 分别加热
B . 加澄清石灰水
C . 加稀盐酸
D . 加BaCl2
鉴别Na2CO3和NaHCO3两种固体,不可以采用的方法是:( )
A . 溶于水,加石灰水
B . 加热,将产生的气体通入澄清石灰水
C . 配制成同物质的量浓度的溶液,测pH值
D . 滴加同浓度的盐酸
下列物质的用途中不正确的是( )
A . 纯碱:制糕点
B . 小苏打:发酵粉主要成分
C . 过氧化钠:制O2
D . 碳酸氢钠:治疗胃酸
某纯碱厂技术科的人员对该厂纯碱样品的质量进行检验。其中能够说明纯碱样品中可能含有杂质(NaHCO3)的实验是( )
①样品溶于水,并加入足量的澄清石灰水,变浑浊;
②样品溶于水,并加入足量的BaCl2溶液,变浑浊;
③样品在硬质试管中加强热,排出的气体通入澄清石灰水,变浑浊;
④向样品中滴加稀盐酸,排出的气体通入澄清石灰水,变浑浊。
A . ①②③
B . ①③④
C . ①②④
D . 只有③
下列有关物质性质的比较,错误的是( )
A . 溶解度(25℃):小苏打<苏打
B . 沸点:H2Se>H2S>H2O
C . 密度:溴乙烷>水
D . 碳碳键键长:乙烯<苯
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( )
A . 取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
B . 取a克混合物充分加热,减重b克
C . 取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
D . 取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
已知少量碳酸钠与足量盐酸反应,有二氧化碳气体放出;而少量盐酸与过量碳酸钠反应,则生成碳酸氢钠和氯化钠,无气体放出.现有A、B两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液.为测定两瓶溶液的成分及物质的量浓度,进行以下实验:
①取20mL A溶液,向其中缓慢滴入B溶液25mL,共收集到112mL(标准状况)气体.
②取25mL B溶液,向其中缓慢滴入A溶液20mL,共收集到56mL(标准状况)气体.
-
(1) 写出少量盐酸与过量碳酸钠反应,无气体放出的离子方程式;
-
(2) 为使上述①②反应完全,还需加入;(填“稀盐酸”或“碳酸钠溶液”)A溶液的物质的量浓度为 mol•L﹣1 .
下列实验装置设计正确、且能达到目的是( )
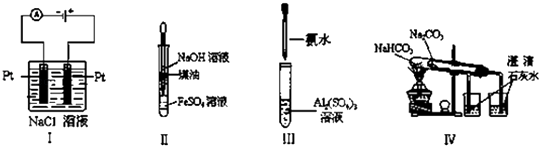
A . 实验Ⅰ:制备金属钠
B . 实验Ⅱ:制取氢氧化亚铁并观察其颜色
C . 实验Ⅲ:制取少量的氢氧化铝
D . 实验Ⅳ:比较两种物质的热稳定性
将0.4g NaOH和1.06g Na2CO3合并配成溶液,向溶液中滴加0.1mol·L—l的盐酸。下图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A . 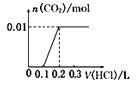 B .
B . 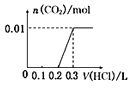 C .
C .  D .
D . 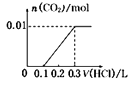
 B .
B .  C .
C .  D .
D . 
将29.6g碳酸钠和碳酸氢钠的混合物加热到质量不再减少为止,冷却,称得固体质量为26.5g。问:原固体混合物中碳酸氢钠的质量是多少?把原固体混合物与足量盐酸完全反应生成的CO2在标准状况下的体积是多少?
下列物质中既能跟稀盐酸反应,又能跟氢氧化钠溶液反应的是( )
① 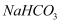 ②
②  ③
③ 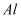 ④
④ 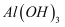 ⑤MgO ⑤Fe(OH) 3 ⑥CuSO4
⑤MgO ⑤Fe(OH) 3 ⑥CuSO4
A . 全部
B . ②③④⑤
C . ①②③④
D . ①②③④⑥
下列叙述Ⅰ和Ⅱ均符合题意并有因果关系的是( )
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | 常温下,SiO2与氢氟酸和NaOH溶液均可反应 | SiO2是两性氧化物 |
B | 常温下,NaHCO3溶解度比Na2CO3小 | 往饱和Na2CO3溶液中通入CO2产生沉淀 |
C | BaSO3难溶于水 | SO2气体通入Ba(NO3)2溶液中产生沉淀 |
D | 非金属性:Cl > S | 酸性:HClO > H2SO4 |
A . A
B . B
C . C
D . D
下列叙述正确的的是( )
A . Na2CO3溶液和NaHCO3溶液可以用Ca(OH)2溶液鉴别
B . 小苏打和氢氧化铝均可与盐酸反应,在医药上常用作胃酸中和剂
C . Na2O 和Na2O2都能与水反应产生碱,所以它们都是碱性氧化物
D . 灼烧白色粉末,火焰呈黄色,证明该粉末中有Na+ , 无K+
为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下,则下列说法正确的是( )

A . X气体可以是空气,反应前和反应后均需通一段时间空气
B . 装置B、C之间缺少CO2的干燥装置
C . 没有a装置会导致所测碳酸钠的质量分数偏高
D . a装置内应装碱石灰,目的是为了尾气处理
下列实验方案中,不能测定出Na2CO3和NaHCO3的混合物中Na2CO3质量分数的是( )
A . 取ag混合物充分加热,质量减少bg
B . 取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到bg固体
C . 取ag混合物与足量NaOH溶液充分反应,得到bg溶液
D . 取ag混合物与足量稀硫酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加bg
下列说法中正确的是( )
A . 第IA族的元素都是碱金属元素
B . 鉴别碳酸钠与碳酸氢钠可以选用氢氧化钙
C . 向氯化铝溶液中加入过量氨水,可制得氢氧化铝
D . 铝易与氧气反应生成氧化铝,说明铝片不能在空气中稳定存在
纯碱和小苏打在工业、生活中有着广泛的应用。现有 和
和 的混合物,为了测定x的值,某同学采用如图所示的装置进行实验(无水
的混合物,为了测定x的值,某同学采用如图所示的装置进行实验(无水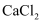 、碱石灰均足量)。
、碱石灰均足量)。
 和
和 的混合物,为了测定x的值,某同学采用如图所示的装置进行实验(无水
的混合物,为了测定x的值,某同学采用如图所示的装置进行实验(无水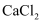 、碱石灰均足量)。
、碱石灰均足量)。
已知:碱石灰是氢氧化钠和氧化钙的固体混合物。请回答下列问题:
-
(1) C装置中装有碱石灰的仪器名称是。
-
(2) 加热A装置,混合物分别发生反应的化学方程式为、。
-
(3) 无水氯化钙的作用是。
-
(4) 若在装置A的试管中装入
 和
和 的混合物
的混合物 , 用酒精灯加热至反应完全,此时B裝置增重
, 用酒精灯加热至反应完全,此时B裝置增重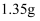 , C装置增重
, C装置增重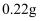 , 则ⅹ的值为。
, 则ⅹ的值为。
-
(5) 该装置还不是很完善,可能使测定结果偏小,应如何改进?。
下列“实验结论”与“实验操作及现象”不相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A | 把一小块钠放入水中,立刻熔成小球 | 该反应是放热反应 |
B | 向某溶液中加入AgNO3溶液,产生白色沉淀 | 该溶液中一定含有Cl- |
C | 向NaHCO3溶液中滴入酚酞溶液,溶液颜色变红 | NaHCO3溶液显碱性 |
D | 向某溶液中加入NaOH溶液,生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色 | 该溶液中一定含有Fe2+ |
A . A
B . B
C . C
D . D
下列描述错误的是( )
A . 纯净的氢气在氯气中安静地燃烧,火焰呈苍白色
B . 可以利用加热的方法来鉴别碳酸钠和碳酸氢钠
C . 钠原子的最外电子层上只有1个电子,在反应中很容易失去,因此,钠的化学性质非常活泼
D . 向装有约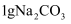 的试管中滴入几滴水后,
的试管中滴入几滴水后, 变成
变成 , 并伴随着吸热现象
, 并伴随着吸热现象
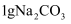 的试管中滴入几滴水后,
的试管中滴入几滴水后, 变成
变成 , 并伴随着吸热现象
, 并伴随着吸热现象
常温下,用如图1所示装置,分别向 溶液和
溶液和 溶液中逐滴滴加
溶液中逐滴滴加 的稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图2所示。下列说法正确的是( )
的稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图2所示。下列说法正确的是( )
 溶液和
溶液和 溶液中逐滴滴加
溶液中逐滴滴加 的稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图2所示。下列说法正确的是( )
的稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图2所示。下列说法正确的是( )
A . X曲线为 溶液的滴定曲线
B . b点溶液的pH大于c点溶液的pH
C . c点的溶液中:
溶液的滴定曲线
B . b点溶液的pH大于c点溶液的pH
C . c点的溶液中: D . a、d两点水的电离程度:a>d
D . a、d两点水的电离程度:a>d
 溶液的滴定曲线
B . b点溶液的pH大于c点溶液的pH
C . c点的溶液中:
溶液的滴定曲线
B . b点溶液的pH大于c点溶液的pH
C . c点的溶液中: D . a、d两点水的电离程度:a>d
D . a、d两点水的电离程度:a>d
最近更新



