氯、溴、碘及其化合物的综合应用 知识点题库
以下均为中学化学常见物质,存在如图转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.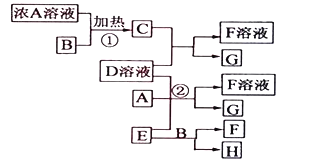
-
(1) G的化学 ;F的电子式
-
(2) 反应②的离子方程式
-
(3) 写出另外一种实验室制取H的化学方程式
-
(4) D溶液中阳离子的焰色反应火焰呈 色;可用 试剂检验D溶液中大量存在的阴离子.
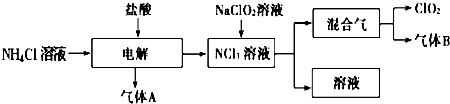
-
(1) ClO2中所有原子(填“是”或“不是”)都满足8电子结构.上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用.
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.蒸馏水
-
(2) 稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是.
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
-
(3) 欧洲国家主要采用氯酸钠氧化浓盐酸制备.化学反应方程式为.缺点主要是产率低、产品难以分离,还可能污染环境.
-
(4) 我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是,此法相比欧洲方法的优点是.
-
(5) 科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为.此法提高了生产及储存、运输的安全性,原因是.
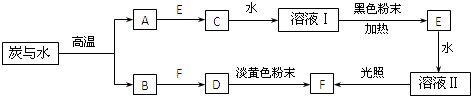
请回答下列问题:
-
(1) 将A点燃后伸入到装有E的集气瓶中,可观察到的现象是.
-
(2) C的浓溶液与黑色粉末反应生成E的化学方程式为.
-
(3) 若将溶液Ⅱ滴入到碘化钾溶液中,发生反应的离子方程式为,向反应后的溶液中加入适量CCl4 , 充分振荡后静置,可以观察到的现象是.
-
(4) 与溶液Ⅰ比较,溶液Ⅱ中多出的物质是(填化学式).
-
(1) 工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,漂白粉的有效成分是(填化学式)有关化学反应方程式为.
-
(2) 漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为.
-
(3) O3与Cl2具有相似的性质,均可用于自来水的消毒.已知二者在消毒时均被还原为最低价态,则相同状况下10L O3与L Cl2的消毒能力相当.
Cl2+H2O⇌HCl+HClO K=4.5×10﹣4
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大).但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其它性能优越的消毒产品所替代.请回答:
-
(1) 氯碱工业生产氯气的化学方程式为.
-
(2) 84消毒液(主要成分为NaClO)与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为.
-
(3) 二氧化氯是一种高效、广谱、安全的杀菌、保鲜剂.我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为.
-
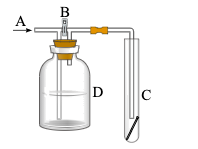
(4) 一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧化性强弱的微型装置(如图).
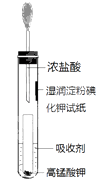
①下列溶液能吸收Cl2的是(填字母序号).
A.饱和食盐水 B.饱和Na2SO3溶液
C.饱和NaOH溶液 D.浓硫酸
②能说明Cl2的氧化性强于I2的实验现象是.
-
(1) 漂白粉是一种(填“纯净物”或“混合物”),有效成分的化学式为.
-
(2) 工业上制备漂白粉的化学方程式为.
-
(3) 漂白粉溶于水有杀菌消毒作用,其原理是(用化学方程式表示).
-
(4) 家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是 .A . 食醋 B . 食盐 C . 烧碱 D . 纯碱
-
(5) 某同学在探究漂白粉溶液性质时,在漂白粉溶液中加入几滴无色酚酞溶液,发现溶液呈红色,随后溶液迅速褪色,说明漂白粉溶液呈性,并具有性.
-
(6) 明矾是无色晶体,其化学式为KAl(SO4)2•12H2O,是一种常用的净水剂,证明其中含有硫酸根离子的方法为.
-
(1) 氯化亚铜(CuCl)是重要的化工原料,工业上常通过下列反应制备CuCl: 2CuSO4+Na2SO3+2NaCl+Na2CO3=2CuCl↓+3Na2SO4+CO2↑
查阅资料可得,CuCl可以溶解在FeCl3溶液中,请写出该反应的离子方程式。
-
(2) 已知:Cu2O在酸性溶液中发生歧化反应:Cu2O+2H+=Cu2++Cu+H2O。
现将一定量混合物(Fe2O3、Cu2O、CuCl、Fe)溶解于过量稀盐酸中,反应完全后,得到W(包括溶液和少量剩余固体)。
①继续往W中通入足量的氯气,不断搅拌,充分反应,溶液中哪些离子的物质的量一定有明显变化?(用离子符号表示)。
②不通入气体,改往W中加入过量铁粉,过滤,调pH约为7,加入淀粉-KI溶液和H2O2溶液,溶液呈蓝色并有红褐色沉淀生成。当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是
-
(3) 某工厂废水中含KCN,其浓度为650 mg·L-1 , 现用氯氧化法处理,发生如下反应(化合物中N化合价均为-3) :KCN+2KOH+Cl2=KOCN+2KCl+H2O。
①通入过量氯气,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
_KOCN+_KOH+_ Cl2=_ CO2+_ N2+_KCl+_H2O。
②若将5 m3含KCN的浓度为650 mg·L-1的废水中KCN氧化成N2除去,需要标准状况下的氯气的体积为L。
-
(4) 二氧化氯是国际公认的高效安全杀菌消毒剂,工业制备ClO2的反应原理:2NaClO3+4HCl=2ClO2 ↑+Cl2↑+2H2O+2NaCl。
①该反应中,氧化剂和还原剂的物质的量之比为,依据氧化还原反应规律判断,氧化性强弱为NaClO3 (填“>"<"或“=")Cl2.。
②ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO
 ),需将其转化为Cl-除去,下列试剂中,可将ClO
),需将其转化为Cl-除去,下列试剂中,可将ClO  转化为Cl-的是 (填字母)。
转化为Cl-的是 (填字母)。A.FeSO4 B.O3 C.KMnO4 D.SO2
-
(5) 亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。Mathieson方法制备亚氯酸钠的流程如下:
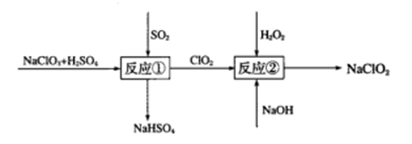
请将流程中反应②的离子方程式补充完整:
_ClO2+_H2O2+_=_ ClO
 + O2+_。
+ O2+_。
-
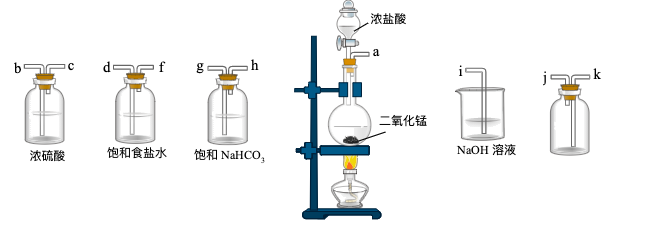
(1) 上述实验制取氯气的化学反应方程式为,其中还原剂和氧化产物物质的量之比为。
-
(2) 从上述仪器中选择必要仪器并按顺序连接(填各接口处的字母):;
-
(3) 如图所示,在A处通入干燥纯净的氯气。当打开B处的弹簧夹时,C处的红布条看不到明显现象:当关闭B处的弹簧夹后,C处的红布条逐渐褪色。则D瓶中盛放的溶液可能是____(填字母)
 A . 饱和NaCl溶液 B . NaOH溶液 C . 浓硫酸
A . 饱和NaCl溶液 B . NaOH溶液 C . 浓硫酸 -
(4) 工业上通常将氯气通入石灰乳中制备漂白粉,请写出该反应的化学方程式。
-
(5)
 是一种灰黑色的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:取一定量的
是一种灰黑色的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:取一定量的 溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:假设1:
假设2:
 被
被 氧化
氧化请你完成下表,验证假设
实验步骤
预期现象
结论
Ⅰ.取少量黄色溶液于试管中,滴加淀粉溶液
假设1正确
Ⅱ.取少量黄色溶液于试管中,滴加
假设2正确
-
(1) Ⅰ.海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室从海带中提取碘的流程如下:
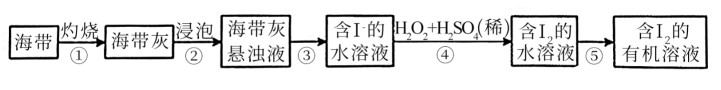
步骤①灼烧海带时,盛放海带的仪器名称是。
-
(2) 步骤④中反应的离子方程式为。
-
(3) 步骤⑤的操作名称为。
-
(4) 步骤⑤可以选择的有机试剂是____(填标号)。A . 四氯化碳 B . 酒精 C . 苯 D . 醋酸
-
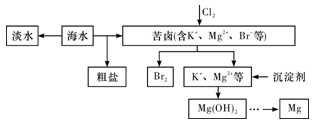
(5) Ⅱ.下图是从海水中提取镁的简单流程。
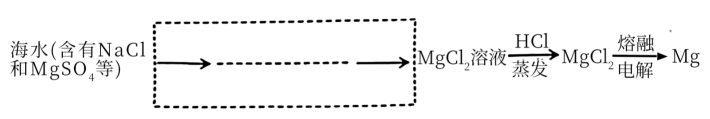
最后一步反应的化学方程式为。
-
(6) 核图示方式补全虚线部分缺少的流程。
 是黄绿色气体,可用于制氯仿
B .
是黄绿色气体,可用于制氯仿
B . 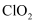 具有强氧化性,可用于环境消毒
C . HClO具有弱酸性,可用于漂白纸张
D . NaCl溶液呈中性,可用于工业制氯气
具有强氧化性,可用于环境消毒
C . HClO具有弱酸性,可用于漂白纸张
D . NaCl溶液呈中性,可用于工业制氯气



