氯、溴、碘及其化合物的综合应用 知识点题库
某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)( )
A . 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-=Cl-+ClO-+H2O
B . 该消毒液的pH约为12:ClO-+ H2O
 HClO+ OH-
C . 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++Cl-+ ClO-= Cl2 ↑+ H2O
D . 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+ CH3COO-
HClO+ OH-
C . 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++Cl-+ ClO-= Cl2 ↑+ H2O
D . 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+ CH3COO-
 HClO+ OH-
C . 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++Cl-+ ClO-= Cl2 ↑+ H2O
D . 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+ CH3COO-
HClO+ OH-
C . 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++Cl-+ ClO-= Cl2 ↑+ H2O
D . 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+ CH3COO-
向盐酸中加入浓硫酸时产生白雾,下列叙述不属于产生该现象的原因是( )
A . 浓硫酸具有脱水性
B . 浓硫酸具有吸水性
C . 盐酸具有挥发性
D . 气体的溶解度的随温度升高而降低
以下物质间的转化通过一步反应不能实现的是( )
A . HCl→Cl2→HClO→NaClO
B . Na→Na2O2→Na2CO3→NaHCO3
C . Si→SiO2→H2SiO3→Na2SiO3
D . Al→NaAlO2→Al(OH)3→Al2O3
下列说法不正确的是( )
A . 汽车尾气中的氮氧化物源于汽油的不完全燃烧
B . 碘化银可用于人工降雨
C . 液氨汽化时吸收大量的热,故可做制冷剂
D . 在医疗上硫酸亚铁可用于生产防治缺铁性贫血的药剂
方志敏烈士生前在狱中曾用米汤(内含淀粉)给鲁迅先生写信,鲁迅先生收到信后,为了看清信中内容,可使用的化学试剂是( )
A . 碘化钾
B . 溴水
C . 碘酒
D . 碘化钾淀粉溶液
下列推断正确的是( )
A . 氯化氢是强电解质,醋酸是弱电解质,盐酸溶液的导电性一定强于醋酸溶液
B . 不论是浓硝酸还是稀硝酸,与铜反应均体现出硝酸的酸性和强氧化性
C . SO2、NO、NO2都是形成酸雨的因素,都能和水反应生成酸
D . 氯元素的非金属性强于碳元素,氯元素含氧酸的酸性都大于碳元素的含氧酸的酸性
有关物质漂白性的叙述,正确的是( )
A . 因为SO2有漂白性,所以它能使品红溶液、溴水褪色
B . 能使品红溶液褪色的气体不一定是SO2
C . SO2、HClO、活性炭都能使红墨水褪色,其原理相同
D . SO2和Cl2都有漂白作用,将两种气体同时作用于湿润的有色布条,漂白效果更好
近期埃博拉病毒在非洲各国肆虐,严重威胁了非洲人民的生命.在此期间,环境消毒是极其关键的,常常喷洒一种名为“84”的消毒液,其有效成分为NaClO.下列有关“84”消毒液的说法正确的是( )
A . NaClO属于共价化合物
B . “84”消毒液在空气中久置会变质
C . 1L 0.1mol∙L﹣1NaClO溶液中ClO﹣的数目为0.1NA
D . ClO﹣与Ca2+、Fe2+、Al3+ 能大量共存
漂白粉的主要成分是;有效成分是;漂白原理是(用方程式表示).
某消毒液的主要成分为NaClO(混有少量NaCl),请用相应的化学用语来解释下列事实.
-
(1) 该消毒液可用NaOH溶液吸收Cl2制备,化学方程式为.
-
(2) 该消毒液的pH约为12,离子方程式为
-
(3) 向FeSO4溶液中滴入少量该溶液,溶液颜色变成棕黄色,反应的离子方程式为
-
(4) 该消毒液不能与洁厕灵(主要成分为浓盐酸)混用,否则会产生中毒危险.每产生1mol Cl2(标准状况下),转移电子个数约为.
某溶液中含有的溶质是FeBr2、FeI2 , 若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色(已知:AgBr、AgI分别为浅黄色和黄色不溶于硝酸的沉淀),则下列叙述正确的是( )
A . 原溶液中的Br﹣可能未被氧化
B . 反应后的溶液中是否含有Fe2+可以用氯水和KSCN溶液检验
C . 取所得溶液加入CCl4后静置分液,向上层溶液中加入足量AgNO3 溶液,能产生黄色沉淀
D . 反应后的溶液中一定不存在Fe2+
HClO属于( )
A . 电解质
B . 非电解质
C . 强酸
D . 氧化物
氯元素的单质及其化合物在生产生活中都很重要.回答下列问题:
-
(1) 与氯元素同族的短周期元素的原子结构示意图为.
-
(2) 与氯元素同周期的离子半径最小的元素的单质是,它的冶炼方法是电解法,冶炼时常加入冰晶石(Na3AlF6),作用是,电解时阳极材料要定期更换,原因是.
-
(3) 某烃在一定条件下和氯气反应生成1,2﹣二氯﹣3,3﹣二甲基戊烷.
①如果该烃是烯烃,则可能的结构简式是,
②如果该烃是炔烃,则可能的结构简式是,
③该烃加氢后生成物的同分异构M的一氯代物有3种,则M的名称是.
-
(4) 工业上,通过如下转化可制得KClO3晶体:
NaCl溶液
 NaClO3溶液
NaClO3溶液  KClO3晶体
KClO3晶体①完成Ⅰ中反应的总化学方程式:.
②Ⅱ中转化的基本反应类型是,该反应过程能析出KClO3晶体而无其他晶体析出的原因是.
-
(5) 一定条件下,在水溶液中1mol Cl﹣、ClO
 (x=1,2,3,4)的能量(kJ)相对大小如图所示.
(x=1,2,3,4)的能量(kJ)相对大小如图所示. 
①D是(填离子符号).
②A+C→B反应的热化学方程式为 (用离子符号表示).
“84”消毒夜在日常生活中被广泛使用.该消毒液无色,pH大于7,对某些有色物质有漂白作用.你认为它可能的有效成分是( )
A . SO2
B . Na2CO3
C . 氯水
D . NaClO
KIO3可作为食盐中的补碘剂。利用“KIO3氧化法”制备KIO3包括以下两个反应:①11KClO3+6I2+3H2O=6KH(IO3)2+3Cl2↑+5KCl
② 2KH(IO3)2+KOH=2KIO3+H2O下列说法正确的是( )
A . 反应①表明氧化性:KH(IO3)2>KClO3
B . 反应①中每转移4mol电子生成2.24L Cl2
C . 向淀粉溶液中加入少量碘盐,溶液会变蓝
D . 可用焰色反应实验证明碘盐中含有钾元素
用高分子吸附树脂提取卤水中的碘(主要以I-形式存在)的工艺流程如图:下列说法错误的是( )

A . 高分子树脂在流程中起到富集I2的作用
B . ④中的Na2SO3起到氧化剂的作用
C . 若②和⑤中分别得到等量的I2 , 则消耗的n(Cl2):n(KClO3)=5:2
D . 由⑥得到碘产品的过程,主要发生的是物理变化
下列说法正确的是( )
A . 工业采用氢气与氯气混合点燃,加水稀释的方法制备盐酸
B . 工业上制备硝酸时,常将通过吸收塔的尾气重新转移至热交换器中,以便于尾气进行后期的循环利用
C . 工业上常采用电解饱和食盐水的方法制备钠单质
D . 工业上常将氯气通入海水的母液中,再进行结晶、过滤从而获得溴单质
将氯水分别滴加到盛有等浓度的 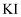 溶液、
溶液、  溶液的试管中,对比观察。通过此实验能够观察到的现象或得出的结论正确的是( )
溶液的试管中,对比观察。通过此实验能够观察到的现象或得出的结论正确的是( )
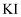 溶液、
溶液、  溶液的试管中,对比观察。通过此实验能够观察到的现象或得出的结论正确的是( )
溶液的试管中,对比观察。通过此实验能够观察到的现象或得出的结论正确的是( )
A . 两支试管中溶液均呈紫色
B . 可证明还原性强弱:  C . 可证明氧化性强弱:
C . 可证明氧化性强弱:  D . 可证明
D . 可证明  的氧化性强于
的氧化性强于  和
和 
 C . 可证明氧化性强弱:
C . 可证明氧化性强弱:  D . 可证明
D . 可证明  的氧化性强于
的氧化性强于  和
和 
实验室里可用如下图所示的装置制取氯酸钾、次氯酸钠,并验证氯水的性质。

图中a为氯气发生装置,c的试管中盛有15mL30%的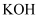 溶液,并置于热水浴中,d的试管中盛有15mL 8%的
溶液,并置于热水浴中,d的试管中盛有15mL 8%的 溶液,并置于冰水浴中,f为
溶液,并置于冰水浴中,f为 的发生装置。
的发生装置。
-
(1) 制取氯气时,在烧瓶中先加入一定量的
 固体,再通过(填写仪器名称)向烧瓶中加入适量的浓盐酸。
固体,再通过(填写仪器名称)向烧瓶中加入适量的浓盐酸。
-
(2) 装置b的作用是。
-
(3) f装置中反应的化学方程式为。
-
(4) 比较制取氯酸钾和次氯酸钠的条件,两者的差异是。
-
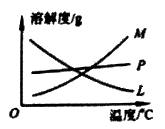
(5) 反应完毕经冷却后,c装置的试管中有大量晶体析出,图中符合该晶体溶解度随温度变化规律的曲线是(选填字母);从c装置的试管中分离该晶体的操作是(填写实验操作名称)。
-
(6) 将d中余气与f中产生的气体通入e中,产生的现象为。
-
(7) 该实验有一处明显的缺点是。
下图是氯元素的价类二维图,其中X、Y、Z为含氯化合物。下列说法不正确的是( )

A . X与Z的水溶液反应生成 B . Y的化学名称为次氯酸
C . Z可用作漂白剂,漂白原理与
B . Y的化学名称为次氯酸
C . Z可用作漂白剂,漂白原理与 相同
D . 将
相同
D . 将 通入
通入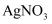 溶液中产生白色沉淀
溶液中产生白色沉淀
 B . Y的化学名称为次氯酸
C . Z可用作漂白剂,漂白原理与
B . Y的化学名称为次氯酸
C . Z可用作漂白剂,漂白原理与 相同
D . 将
相同
D . 将 通入
通入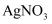 溶液中产生白色沉淀
溶液中产生白色沉淀
最近更新



