氯、溴、碘及其化合物的综合应用 知识点题库
(1)观察氯水颜色,发现氯水呈黄绿色,说明氯水中肯定含有的粒子是
(2)取少量氯水于试管中,滴入硝酸酸化的AgNO3溶液,有白色沉淀生成,说明氯水中含有的粒子是
(3)在氯水中的试管中加有色布条褪色,说明氯水中含有

-
(1) 小组同学依据漂白液具有漂白消毒的性质推测,漂白液中ClO﹣具有氧化性.实验如下:
Ⅰ.用pH试纸检验,漂白液pH>7,饱和KAl(SO4)2溶液pH<7.
Ⅱ.取10mL漂白液,依次加入Na2SO3溶液和BaCl2溶液,有白色沉淀生成,经检验白色沉淀不溶于盐酸.
Ⅲ.另取10mL,漂白液,加入品红溶液,溶液红色逐渐变浅,一段时间后褪为无色.
Ⅳ.再取10mL漂白液,加入品红溶液,加入少量稀硫酸酸化后,溶液红色立即变为无色.
①漂白液pH大于7的原因是(用离子方程式表示).
②由实验Ⅱ得出ClO﹣具有氧化性,写出反应的离子方程式.
③对比实验Ⅲ和Ⅳ说明ClO﹣氧化性与溶液酸碱性的关系是.
-
(2) 小组同学依据(1)中的实验,提出:漂白液在酸性溶液中有Cl2生成.用如图所示的装置继续实验,探究漂白液在酸性溶液中是否能反应生成Cl2 .
①装置B的作用是.
②若打开分液漏斗活塞向烧瓶中加入硫酸,不久烧瓶中有黄绿色气体产生.A中反应的离子方程式.
③若打开分液漏斗活塞向烧瓶中加入饱和KAl(SO4)2溶液,首先观察到产生大量的白色胶状沉淀,不久烧瓶中有黄绿色气体产生.A中加KAl(SO4)2溶液反应的离子方程式是.
-
(3) 上述实验说明漂白液与酸性溶液混合会产生Cl2 . 若取10mL漂白液与足量BaCl2溶液混合后,不断通入SO2至过量,在实验过程中可能的实验现象是.
-
(1) 2015年8月12日天津港危化品爆炸,教训极为深刻.其中化学品之一是氰化钠(NaCN):白色固体,可溶于水,剧毒,致死量50~250mg.氰化钠遇水或酸生成剧毒易燃的氰化氢(HCN)气体.处理氰化物可用碱性氯化法,该方法发生三步反应,写出其离子方程式.
①氯气与氢氧化钠溶液反应生成次氯酸盐(ClO﹣):.
②次氯酸盐氧化氰化物(CN﹣)生成氰酸盐(CNO﹣):ClO﹣+CN﹣═CNO﹣+2Cl﹣
③过量的次氯酸盐氧化氰酸盐生成CO32﹣和N2:.
-
(2) 用ClO2 处理泄漏的氰化钠(NaCN),得到无毒的NaCl、N2 和CO2 . 若处理含NaCN 4×10﹣5mol•L﹣1的废水 1000L,至少需要ClO2 的质量为 g.
-
(3) 化学是一门以实验为基础的科学,下列叙述正确的是(填写序号).
①将0.2mol•L﹣1FeCl3溶液滴加到沸水中,然后继续加热并不断搅拌可制得氢氧化铁胶体.
②分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出.
③用NaOH固体配制100g 10%的氢氧化钠溶液时,用到的玻璃仪器主要有玻璃棒、
烧杯、量筒和胶头滴管.
④托盘天平、容量瓶、量筒、滴定管等定量仪器均标有0刻度线.
⑤除去CO2中HCl,可将混合气体通过盛有饱和Na2CO3溶液的洗气瓶.
⑥纯净的氢气在氯气中安静地燃烧,产生苍白色火焰,瓶口伴有白雾.
⑦加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32﹣ .
-
(4) 化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是A . 定性检验SO32﹣ , 可用HNO3酸化的BaCl2溶液 B . 配制FeCl2溶液时通常加少量HNO3酸化,减小其水解程度 C . 检验某溶液中是否含Cl﹣ , 用HNO3酸化的AgNO3溶液 D . 检验氧化铁中的氧化亚铁,先用硫酸溶液溶解,然后加入盐酸酸化的高锰酸钾溶液.
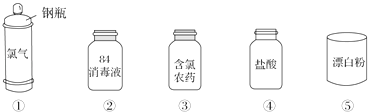
-
(1) ①中钢瓶上应贴的标签为 .A . 腐蚀品 B . 爆炸品 C . 有毒品 D . 易燃品
-
(2) 下列有关漂白粉和漂白液的说法正确的是 .A . 漂白粉是纯净物,漂白液是混合物 B . 漂白粉的有效成分是Ca(ClO)2 C . 工业上将氯气通入澄清石灰水制取漂白粉 D . 漂白液的有效成分是Na2O2
-
(3) 工业上利用Cl2制盐酸,其化学方程式为.Cl2溶于水可制得氯水,检验一瓶氯水是否已经完全变质,可选用的试剂是.
A.硝酸银溶液 B.酚酞溶液 C.碳酸钠溶液 D.紫色石蕊溶液
-
(4) 将8.7g MnO2与足量浓盐酸混合加热,反应生成氯气的体积(标准状况)是 L;被氧化的HCl的质量是 g.
-
(1) ClO2的名称为,氯元素的化合价为.
-
(2) 制取ClO2的微观过程如图所示:
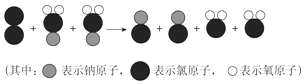
该反应的化学方程式是.
-
(1) 野炊时同学们用铁锅 烧饭、炒菜,是利用了铁锅的 (填字母序号);A . 导电性 B . 导热性 C . 延展性
-
(2) 野炊的食谱如下:馒头、猪肉、矿泉水、牛肉干.从营养均衡的角度来看.该食谱还应该添加 (填字母序号);A . 鸡蛋 B . 面条 C . 黄瓜 D . 兔肉
-
(3) 厨房清洁剂(pH=12.5)与厕所清洁剂(pH=1.6)要分开放,更不能混合使用,其原因是.

通入氯气一段时间,KI溶液变为黄色。继续通入氯气一段时间后,溶液黄色褪去,变为无色。继续通入氯气,最后溶液变为浅黄绿色。
-
(1) Cl2与NaOH溶液反应的化学方程式是;
-
(2) KI溶液变为黄色说明氯气具有性,该反应的离子方程式是;
-
(3) 已知
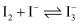 ,
, 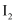 、
、 在水中均呈黄色。为确定黄色溶液的成分,进行以下实验:
在水中均呈黄色。为确定黄色溶液的成分,进行以下实验:操作
实验现象
a
取2~3mL黄色溶液,加入足量
 , 振荡静置
, 振荡静置 层呈紫红色,水层显浅黄色
层呈紫红色,水层显浅黄色b
取2~3mL饱和碘水,加入足量
 , 振荡静置
, 振荡静置 层呈紫红色,水层几近无色
层呈紫红色,水层几近无色①实验b的目的是;
②根据实验a可知,水层中含有的粒子有;
③用化学平衡原理解释实验a中水溶液颜色变浅的原因:;
-
(4) 通入氯气,溶液由黄色变为无色,是因为氯气将
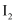 氧化。已知
氧化。已知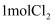 可氧化
可氧化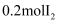 , 该反应的离子方程式是;
, 该反应的离子方程式是;
-
(5) 根据上述实验,请预测向淀粉-KI溶液中持续通入氯气,可能观察到的现象为;
-
(6) 溶液最终变为浅黄绿色的原因是。
 CuCl2(aq)
CuCl2(aq)  Cu(OH)2(s)
B . NaOH(aq)
Cu(OH)2(s)
B . NaOH(aq) 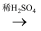 Na2SO4(aq)
Na2SO4(aq)  Na2CO3(s)
C . C(s)
Na2CO3(s)
C . C(s)  CO2(g)
CO2(g) 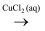 CaCO3(s)
D . Ca(ClO)2(aq)
CaCO3(s)
D . Ca(ClO)2(aq) 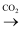 HClO(aq)
HClO(aq) 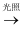 O2(g)
O2(g)



