工业合成氨 知识点题库

(1)实验室制取氨气的化学方程式是 .
(2)工业上氨气可以由氢气和氮气合成如图1.

①该反应的热化学方程式是 .
②随着温度的升高,该反应的化学平衡常数的变化趋势是 .
③一定温度下,2L密闭容器中,5mol N2和5mol H2发生反应,达到平衡时,N2的转化率为20%,该温度下反应的平衡常数的数值是 (填字母).
④简述一种检查氨气是否泄露可采用的化学方法: .
(3)工业制硫酸的尾气中含较多的SO2 , 为防止污染空气,回收利用SO2 , 工业上常用氨水吸收法处理尾气.
①当氨水中所含氨的物质的量为3mol,吸收标准状况下44.8L SO2时,溶液中的溶质为 .
②(NH4)2SO3显碱性,用化学平衡原理解释 .
③NH4HSO3显酸性.用氨水吸收SO2 , 当吸收液显中性时,溶液中离子浓度关系正确的是 (填字母).
a.c(NH4+)=2c(SO32﹣)+c(HSO3﹣)
b.c(NH4+)>c(SO32﹣)>c(H+)=c(OH﹣)
c.c(NH4+)+c(H+)=c(SO32﹣)+c(HSO3﹣)+c(OH﹣)
(4)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理如图2:
①氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液.
②空气在进入电池装置前需要通过过滤器除去的气体是 .
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池的电极总反应是 ,正极的电极反应方是 .
工业上制取硝酸铵的流程图如下,请回答下列问题:
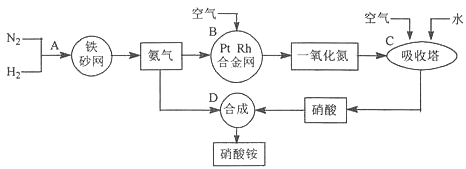
-
(1) 合成氨的工业设备名称是,设备中设置热交换器的目的是;此生产过程中,N2与H2合成NH3所用的催化剂是;生产中原料气必须进行脱硫,目的是。
-
(2) 吸收塔中的反应为,从生产流程看,吸收塔中需要补充空气,其原因是。
-
(3) 生产硝酸的过程中常会产生一些氮的氧化物,可用如下三种方法处理:
方法一:碱吸收法:NO+NO2+2NaOH=2NaNO2+H2O,2NO2+Na2CO3=NaNO2+NaNO3+CO2
方法二:氨还原法:8NH3+6NO2=7N2+12H2O(该反应放热,NO也有类似的反应)
方法三:甲烷吸收法:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g) △H=+867kJ·mol-1(NO也有类似的反应)上述三种方法中方法一最大的缺点是;方法三和方法二相比,优点是,缺点是。
-
(4) 某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用的NH3的质量占总耗NH3质量(不考虑其他损耗)的%(保留三位有效数值)。

-
(1) 原料气进入压缩机前需要进行净化处理,其目的是.制备氨合成塔的材料(填“能”或“不能”)使用普通的碳素钢.
-
(2) N2、H2混合气体经压缩后再送入氨合成塔,优点是. 某整个生产中循环使用某些原料可提高生产效益,能循环利用的物质是.
-
(3) 请按要求填写下列空白.
①沉淀池中的离子方程式:.
②生产尿素的化学方程式:.
-
(4) 在较低温度下,可从沉淀池的溶液中分离出一种副产品由此可推断,低温下NH4Cl的溶解度很可能(填“小于”或“大于”)NaCL.NH4Cl是一种氮肥,但长期施用易使土壤酸化,用离子方程式表示其原因.
-
(5) 以焦炭、水为原料制备H2 (碳转化为CO2 , 则1000g纯度为a%((杂质不与水反应)焦炭最多可制备 g尿素(已知合成氨时h2的利用率为b%、合成尿素时NH3的利用率为c%)

回答下列问题:
-
(1) 合成氨所需的氮气来源于;合成氨所需的原料气氢气可由天然气制备,其主要反应为CH4(g)+H2O(g)=CO(g)+3H2(g);CH4和O2的反应:2CH4(g)+O2(g)=2CO(g)+4H2(g).CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气中氧气含量不同)混合反应,产物气体组成如表:
气体
CO
H2
N2
O2
体积(L)
25
60
15
2.5
计算该富氧空气中O2和N2的体积比V(O2):V(N2)=.
-
(2) 在合成氨的原科气中混有的杂质必须除去的原因是;
上述流程中热交换器的作用是.从合成塔出来的混合气体,通常仅含有15%(体积分数)的氨.为提高原料的利用率,通常采取的措施是.
-
(3) 合成氮为放热反应,但工业上采用400℃﹣500℃的温度,主要原因是:
①该温度范围内反应速率较快.②.
-
(4) 氨可与CO2反应制备尿素(CO(NH2)2],反应过程分为两步,试写出有关的化学方程式:
①氮气与二氧化碳在加热加压条件下化合生成氨基甲酸铵(H2NCOONH4):.
②氨基甲酸铵受热分解为尿素与水:.
-
(5) 新法合成氨常采用电解法合成.即常压下将氢气和用氢气稀释的氮气分别通入一个加热到570℃的电解池中,氢气和氮气在电极上合成了氨,大大提高了氨的产率.新法合成氨所用的电解质能传导H+ , 则阴极的电极反应式为.
-
(1) 在一定条件下:2N2(g)+6H2O(g)═4NH3(g)+3O2(g).已知该反应的相关的化学键键能数据如下:
化学键
N≡N
H﹣O
N﹣H
O=O
E/(kJ/mol)
946
463
391
496
则该反应的△H=kJ/mol.
-
(2) 电厂烟气脱氮的主要反应I:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(g)△H<0,副反应II:2NH3(g)+8NO(g)⇌5N2O(g)+3H2O(g)△H>0.
①反应I的化学平衡常数的表达式为.
②对于在2L密闭容器中进行的反应I,在一定条件下n(NH3)和n(N2)随时间变化的关系如图1所示:

用NH3表示从开始到t1时刻的化学反应速率为(用a、b、t表示)mol/(L•min),图中表示已达平衡的点为.
③电厂烟气脱氮的平衡体系的混合气体中N2和N2O含量与温度的关系如图2所示,在温度420~550K时,平衡混合气体中N2O含量随温度的变化规律是,造成这种变化规律的原因是.
-
(3) 电化学降解法可治理水中硝酸盐的污染.电化学降解NO3﹣的原理如图3所示,电源正极为(填“a”或“b”),阴极电极反应式为.
 甲装置可用来模拟工业制取NaHCO3 , 实验时为防止倒吸,应先通入CO2一段时间后再通NH3
B .
甲装置可用来模拟工业制取NaHCO3 , 实验时为防止倒吸,应先通入CO2一段时间后再通NH3
B .  乙装置可用来萃取溴水中的溴,放出下层水后,另换洁净的烧怀放出有机层
C .
乙装置可用来萃取溴水中的溴,放出下层水后,另换洁净的烧怀放出有机层
C .  丙装置可用来分离四氯化碳和苯的混合物,其中直形冷凝管可用球形冷凝管代替
D .
丙装置可用来分离四氯化碳和苯的混合物,其中直形冷凝管可用球形冷凝管代替
D .  丁装置可用来做喷泉实验,若在水中滴入少量酚酞,实验中可观察到红色喷泉
丁装置可用来做喷泉实验,若在水中滴入少量酚酞,实验中可观察到红色喷泉
N2(g) +3H2(g)  2NH3(g) △H= - 92. 2 KJ·mol-1
2NH3(g) △H= - 92. 2 KJ·mol-1

-
(1) 1mol N-H键断裂吸收的能量为kJ。
-
(2) 对于N2(g) +3H2(g)
 2NH3(g) △H= - 92. 2 KJ·mol-1反应
2NH3(g) △H= - 92. 2 KJ·mol-1反应①只改变某一条件,一定可以提高平衡体系中H2的转化率,又能加快反应速率的措施是()。
A.升高温度
B.移走NH3
C.加入催化剂
D.再充入N2
②向1L密闭容器中加入1mol N2、3molH2 , 下列叙述能说明此反应达到平衡状态的是()。
A.混合气体的平均相对分子质量保持不变
B.N2和H2的转化率相等
C. H2的体积分数保持不变
D.混合气体的密度保持不变
-
(3) 下图表示500℃、60.0 MPa条件下,原料气H2、 N2投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:。(保留3位有效数字)

-
(4) 合成尿素的反应:2NH3(g)+CO (g)=CO(NH2)2(g)+H2(g) △H =-81.0kJ/mol;T℃时,在体积为2L的恒容密闭容器中,将2 mol的NH3和1mol CO混合反应,5 min时,NH3的转化率为80%。已知:

则:K1 126.5(填“>”或“< ”);其判断理由是。
-
(1) 工业上合成氨气
-
(2) 铜和稀硝酸 其中硝酸的作用为
-
(3) 氨气的催化氧化,其中氧化剂与还原剂物质的量之比为
-
(4) 用离子反应表示如何检验NH4+
-
(1) 科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。

由图可知合成氨反应
 N2(g)+
N2(g)+  H2(g)
H2(g)  NH3(g)的∆H= kJ·mol-1。该历程中反应速率最慢的步骤的化学方程式为。
NH3(g)的∆H= kJ·mol-1。该历程中反应速率最慢的步骤的化学方程式为。 -
(2) 工业合成氨反应为:N2(g)+3H2(g)
 2NH3(g),当进料体积比V(N2):V(H2)=1:3时平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
2NH3(g),当进料体积比V(N2):V(H2)=1:3时平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示: 
①500℃时,反应平衡常数Kp(30MPa) Kp(100MPa)。(填“<”、“=”、“>”)
②500℃、30MPa时,氢气的平衡转化率为(保留2位有效数字),Kp=(MPa)-2(列出计算式)。
-
(3) 科学家利用电解法在常温常压下实现合成氨,工作时阴极区的微观示意如图,其中电解液为溶解有三氟甲磺酸锂和乙醇的惰性有机溶剂。

①阴极区生成NH3的电极方程式为。
②下列说法正确的是(填标号)。
A.三氟甲磺酸锂的作用是增强导电性
B.该装置用金(Au)作催化剂目的是降低N2的键能
C.选择性透过膜可允许N2和NH3通过,防止H2O进入装置
-
(1) 若1 mol N2完全反应生成NH3可(填“吸收”或“放出”)热量kJ。
-
(2) 如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是。
-
(3) 一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
-
(1) 研究表明金属催化剂可加速氨气的分解。某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解生成氢气的初始速率(单位:mmol/min)与催化剂的对应关系如表所示。
催化剂
Ru
Rh
Ni
Pt
Pd
Fe
初始速率
7. 9
4.0
3.0
2.2
1.8
0.5
①在不同催化剂的催化作用下,氨气分解反应的活化能最大的是(填写催化剂的化学式)。
②温度为T时,在恒容的密闭容器中加入2 mol NH3 , 此时压强为p0 , 用Ru催化氨气分解,若平衡时氨气的转化率为50%,则该温度下反应2NH3(g)
 N2(g)+3H2(g)的化学平衡常数Kp=。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压p总×体积分数)
N2(g)+3H2(g)的化学平衡常数Kp=。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压p总×体积分数) -
(2) 关于合成氨工艺的理解,下列说法错误的是(填标号)。
A合成氨工业常采用的反应温度为500 ℃左右,主要是为了节约能源
B使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产率
C合成氨工业采用的压强为10 MPa~30 MPa,是因为常压下N2和H2的转化率不高
-
(3) 在1 L1 mol/L盐酸中缓缓通入2 mol氨气,请在图1中画出溶液中水电离出的OH-浓度随通入氨气的物质的量变化的趋势图。

-
(4) 电化学法合成氨:图2是用低温固体质子导体作电解质,

用Pt- CN,作阴极,催化电解H2(g)和N2(g)合成NH3的原理示意图。
①Pt—C3N4电极上产生NH3的电极反应式为。
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因:。
 2NH3(g) △H=-92.4 kJ·mol-1.最近,吉林大学与韩国、加拿大科研人员合作研究,提出基于机械化学(“暴力”干扰使铁活化)在温和条件下由氮气合成氨的新方案(过程如图所示),利用这种方案所得氨的体积分数最终可高达82.5%。下列有关分析错误的是( )
2NH3(g) △H=-92.4 kJ·mol-1.最近,吉林大学与韩国、加拿大科研人员合作研究,提出基于机械化学(“暴力”干扰使铁活化)在温和条件下由氮气合成氨的新方案(过程如图所示),利用这种方案所得氨的体积分数最终可高达82.5%。下列有关分析错误的是( ) 
 2NH3(g)ΔH<0。下列说法正确的是( )
2NH3(g)ΔH<0。下列说法正确的是( )
-
(1) 氮在元素周期表的位置为,其非金属性比磷(填“强”或“弱”)。氮气的化学性质很稳定,原因是。
-
(2) 1909年,德国科学家哈伯利用氮气和氢气在500~600℃、18.5~20.0
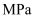 和锇为催化剂的条件下合成氨气。下列关于工业上合成氨的说法合理的是____。
A . 合成氨属于人工固氮 B . 合成原料氢气主要通过电解水获得 C . 将生成的氨气分离,可加快反应速率 D . 通过改良催化剂,可使反应更易发生
和锇为催化剂的条件下合成氨气。下列关于工业上合成氨的说法合理的是____。
A . 合成氨属于人工固氮 B . 合成原料氢气主要通过电解水获得 C . 将生成的氨气分离,可加快反应速率 D . 通过改良催化剂,可使反应更易发生 -
(3) 某兴趣小组在实验室中探究氮的氧化物的性质。
①利用铜和稀硝酸制取NO,化学方程式为,该反应中还原剂与氧化剂物质的量之比为。
②探究氮的氧化物性质的实验步骤及预期现象如下表:

步骤
预期现象
i.在一支注射器中吸入22.4mLNO(标准状况下),然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器
无明显现象
ii.打开弹簧夹,快速吸入10mL空气后夹上弹簧夹,固定住注射署活塞
iii.松开注射器活塞,再振荡注射器
重复操作ii和iii,充分反应后,注射器中的溶液浓度为mol/L(假设反应前后液的体积几乎不变)。
-
(4) 利用
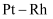 合金催化氧化
合金催化氧化 制取
制取 , 图①是反应的微观模型,含氮生成物产率反应温度的变化曲线如图②所示。下列说法正确的是____。
, 图①是反应的微观模型,含氮生成物产率反应温度的变化曲线如图②所示。下列说法正确的是____。
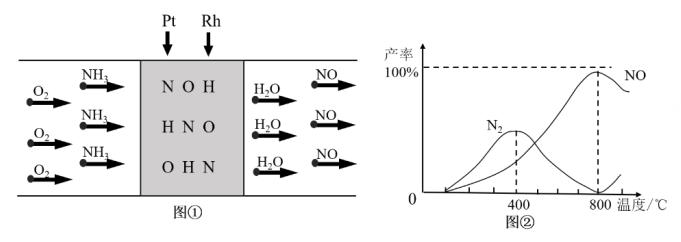 A . 可用湿润的蓝色石蕊试纸检验
A . 可用湿润的蓝色石蕊试纸检验 是否反应完全
B . 400℃时,生成的产物只有
是否反应完全
B . 400℃时,生成的产物只有 、
、 C . 800℃以上,可能发生反应:
C . 800℃以上,可能发生反应: D .
D . 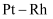 合金催化氧化
合金催化氧化 制取
制取 , 适宜的温度为800℃
, 适宜的温度为800℃

 2NH3
C . 反应③为4LiOH
2NH3
C . 反应③为4LiOH 4Li+2H2O+O2↑
D . 反应①和②均属于“氮的固定”
4Li+2H2O+O2↑
D . 反应①和②均属于“氮的固定”



