浓硫酸的性质实验 知识点题库
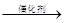 C+NO2
C . 浓硫酸具有吸水性,因此可用作干燥剂,能干燥氢气、硫化氢、氨气等气体
D . 因为浓硫酸在常温下不可与铁或铝反应,因此常温下可用铁制或铝制容器储存浓硫酸
C+NO2
C . 浓硫酸具有吸水性,因此可用作干燥剂,能干燥氢气、硫化氢、氨气等气体
D . 因为浓硫酸在常温下不可与铁或铝反应,因此常温下可用铁制或铝制容器储存浓硫酸
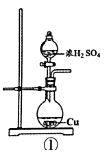
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列实验不合理的是( )

请回答下列问题:
-
(1) 写出铜与浓硫酸反应的化学方程式:.
-
(2) 试管a、b分别检验生成气体的性质,写出观察到的现象及其作用.试管a中的现象是,作用是.试管b中的现象是,作用是.
-
(3) 装置中浸碱面团的作用是.
-
(4) 如图将铜丝改为可抽动的铜丝符合化学实验“绿色化”的原因是.

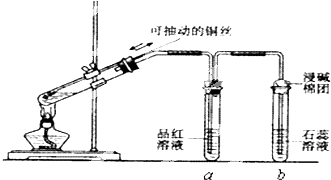
请回答下列问题:
-
(1) B是用来收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整.
-
(2) 实验中他们取6.4g铜片和12mL18mol•L﹣1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余.
①写出铜与浓硫酸反应的化学方程式:,
实验中若有m g铜参加了反应,则有 mol硫酸被(填“氧化”或“还原”),转移电子的物质的量为 mol.
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是(填写字母编号).
A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸钠溶液
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为的原因是
-
(3) 为了测定剩余硫酸的物质的量浓度,该兴趣小组设计了三个实验方案:
方案一:将装置A产生的气体缓缓通过已称量过的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫.
方案二:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即是二氧化硫转化为硫酸钡沉淀的质量.
方案三:当铜和浓硫酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生氢气的体积为V L(已换算为标准状况).
实际上,以上方案一、二均不可取,请你说出原因?
方案一;
方案二.
方案三:写出剩余硫酸的物质的量浓度的计算式(假设反应后溶液的体积仍为12mL).
-
(1) 如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):接,接,接;
-
(2) 仪器乙、丙应有怎样的实验现象才表明已检验出CO2?乙中,丙中;
-
(3) 丁中酸性KMnO4溶液的作用是;
-
(4) 写出甲中反应的化学方程式.
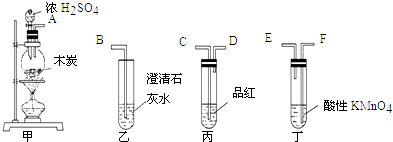
A | B | C | D |
实验室制备Fe(OH)2 | 实验室制氨气 | 制过氧化钠 | 验证浓H2SO4的脱水性、强氧化性 |
|
|
|
|
 B . 用装置②检验和收集SO2
B . 用装置②检验和收集SO2 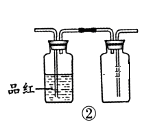 C . 用装置③稀释反应后溶液
C . 用装置③稀释反应后溶液 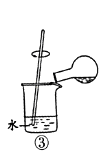 D . 用装置④测定反应后溶液中c(H+)
D . 用装置④测定反应后溶液中c(H+) 
(实验目的)探究 金属的成分
-
(1) (提出假设)猜想1:M的成分是铁和铜;
猜想2:M的成分是铁和铝;
猜想3:M的成分是;
猜想4:M的成分是铁、铜和铝
-
(2) (设计实验)取两份质量均为m g的M样品,按图1和图2装置分别进行实验:实验前后条件都是常温、常压,待样品M充分反应后,按图1、图2实验方案完成实验并测得气体体积分别为V1L和V2L(所测定的气体体积已折合成标准状况)。
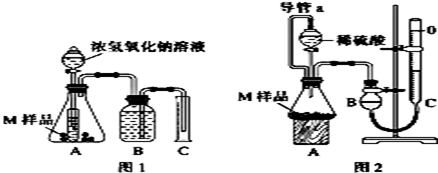
完成实验目的和猜想填空内容。
若该实验需要0.50mol/LNaOH溶液240mL,用规格仪器配制时应称量g NaOH(用托盘天平),若称量的NaOH固体中混有Na2O杂质会导致所配溶液浓度(填“偏大”、“偏小”或“无影响”)
-
(3) 进行实验1前,B瓶中的水没有装满,使测得的气体体积 (填“偏大”、“偏小”或“无影响”),实验2中的导管a的作用为并能防止因加入液体而排出锥形瓶内部分空气,导致测定的气体体积偏大。
-
(4) 若V1≠0,则推测上述猜想 (填“1”、“2”、“3”或“4”)一定不成立,若猜想3成立,则V1V2(填“>”、“<”或“=”)。
-
(5) 若V1<V2≠0,则M样品中铁的质量为g(用含V1和V2式子表示)

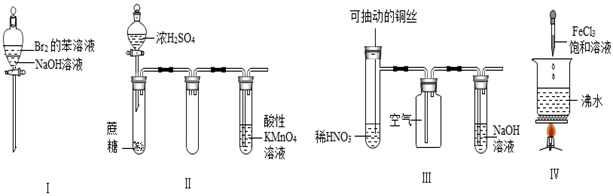
请回答:
-
(1) 浓硫酸与铜片反应的化学方程式为。
-
(2) 反应一段时间后,试管乙中品红溶液的现象是。
-
(3) 下列有关该实验的说法中,错误的是_______________。A . 该反应中浓硫酸只体现酸性 B . 试管乙中含有碱液的棉花,其作用是吸收过量的SO2 , 防止环境污染 C . 反应一段时间后,将试管甲中的溶液缓慢倒入盛有水的烧杯,溶液显蓝色 D . 含0.04mol溶质的浓硫酸与足量的铜片反应,能收集到448mL的SO2(标准状况)
 CO2↑+2SO2↑+2H2O,在此反应中,浓硫酸既表现了强氧化性又表现了酸性
C . 把足量铜粉投入到含2 mol H2SO4的浓硫酸中,加热得到气体体积标准状况下为22.4 L
D . 常温下能够用铁、铝等容器盛放浓硫酸,是因为浓硫酸与其不反应
CO2↑+2SO2↑+2H2O,在此反应中,浓硫酸既表现了强氧化性又表现了酸性
C . 把足量铜粉投入到含2 mol H2SO4的浓硫酸中,加热得到气体体积标准状况下为22.4 L
D . 常温下能够用铁、铝等容器盛放浓硫酸,是因为浓硫酸与其不反应
|
实验目的 |
实验操作 |
|
|
A |
比较碳和硫两种非金属性的强弱 |
测同温同浓度下Na2CO3和Na2SO3水溶液的pH并比较pH大小 |
|
B |
证明浓硫酸具有吸水性 |
在蔗糖中滴加浓硫酸,蔗糖变黑 |
|
C |
配制0.400 mol/L NaOH溶液 |
称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,并马上转移至250 mL容量瓶定容 |
|
D |
比较水和乙醇中羟基上氢的活泼性 |
分别将少量钠投入到盛有水和乙醇的烧杯中 |
| 实验操作 | 实验现象 | ||
| 金属为铜 | 金属为锌 | 金属为铝 | |
| 点燃 | 不燃烧 | 燃烧 | 燃烧 |
| 通入 | 褪色 | 褪色 | 褪色 |
| 通入 | 无明显变化 | 无明显变化 | 出现黑色沉淀 |
| 通入品红溶液 | 褪色 | 褪色 | 不褪色 |
已知:  (CuS为黑色固体);
(CuS为黑色固体);  可燃
可燃
下列说法错误的是( )
 酸性溶液褪色的气体是
酸性溶液褪色的气体是  B . 加入铝片的实验中,燃烧现象能证明生成气体中一定含
B . 加入铝片的实验中,燃烧现象能证明生成气体中一定含  C . 加入锌片的实验中,生成的气体一定是混合气体
D . 金属与浓硫酸反应的还原产物与金属活动性强弱有关
C . 加入锌片的实验中,生成的气体一定是混合气体
D . 金属与浓硫酸反应的还原产物与金属活动性强弱有关

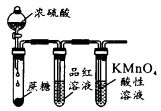
在不影响实验检验结果的情况下,理论上以下试剂中可以用来代替装置B中的品红溶液的是( )
① 溶液 ②
溶液 ② 溶液 ③饱和
溶液 ③饱和 溶液 ④饱和碳酸钠溶液 ⑤溴水 ⑥澄清石灰水
溶液 ④饱和碳酸钠溶液 ⑤溴水 ⑥澄清石灰水
实验 | 结论 | |
A | 将金属钠在燃烧匙中点燃迅速伸入集满 |
|
B | 将打磨过的铝条放入试管,再加入 | 铝与浓硫酸常温下不反应 |
C | 将稀硝酸加入过量铁粉中,充分反应后再滴加 |
|
D | 向鸡蛋白溶液中加入饱和 | 蛋白质发生了变性 |

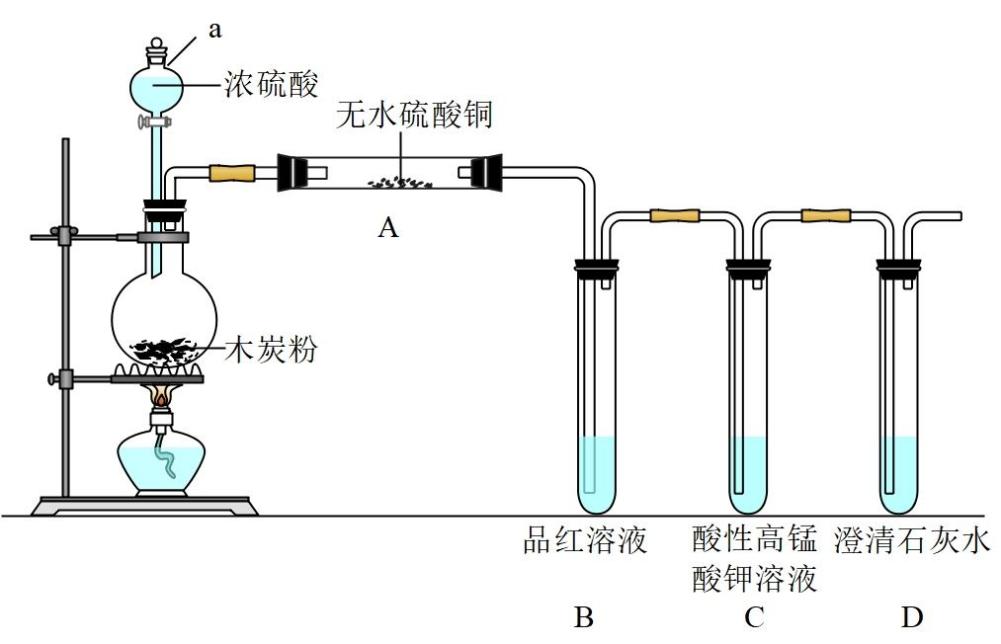
-
(1) 设备I的仪器名称是。
-
(2) 设备II中盛放的试剂是,该试剂的作用是。
-
(3) 浓硫酸与木炭反应的化学方程式是。
-
(4) 证明产物中含有CO2的实验现象是。



 溶液
溶液 的集气瓶,产生大量的白烟,瓶内有黑色颗粒产生
的集气瓶,产生大量的白烟,瓶内有黑色颗粒产生 浓硫酸,铝条表面无明显现象
浓硫酸,铝条表面无明显现象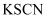 溶液,溶液不呈血红色
溶液,溶液不呈血红色 被稀硝酸氧化为
被稀硝酸氧化为
 溶液,有白色沉淀产生
溶液,有白色沉淀产生


