化学反应速率 知识点题库
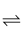 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
2C的反应来说,以下化学反应速率的表示中,反应速率最快的是( )



-
(1) 一定条件下,充入2mol SO2(g)和2mol O2(g),20s后,测得SO2的体积百分含量为12.5%,则用SO2表示该反应在这20s内的反应速率为
-
(2) 下面的叙述可作为判断可逆反应达到平衡状态依据的是(填序号).
①混合气体的密度不变 ②混合气体的平均相对分子质量不变
③v正(SO2)=2v正(O2) ④各气体的浓度都不再发生变化
-
(3) 图1表示该反应的速率(v)随时间(t)的变化的关系.则下列不同时间段中,SO3的百分含量最高的是
A、t2→t3 B、t0→t1 C、t5→t6 D、t3→t4
据图分析:你认为t3时改变的外界条件可能是;
-
(4) 图2中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为aL.试回答:
①反应达到平衡时容器B的体积为1.2a L,容器B中SO3转化率为
②若打开K,一段时间后重新达到平衡,容器B的体积为L(连通管中气体体积忽略不计,且不考虑温度的影响).
 v(SO2)=v(O2)
D . v(O2)=2v(SO2)
v(SO2)=v(O2)
D . v(O2)=2v(SO2)
-
(1) Ⅰ.已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH 溶液中存在电离平衡:CH3COOH ⇌ CH3COO-+H+ ΔH>0。
常温下,在 pH = 5 的稀醋酸溶液中,c(CH3COO-)=(不必化简)。下列方法中,可以使 0.10 mol·L-1 CH3COOH 的电离程度增大的是。
a.加入少量 0.10 mol·L-1 的稀盐酸 b.加热 CH3COOH 溶液
c.加水稀释至 0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量 0.10 mol·L-1 的 NaOH 溶液
-
(2) 将等质量的锌投入等体积且 pH 均等于 3 的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)V(醋酸),反应的最初速率为:υ(盐酸)υ(醋酸)。(填写“>”、“<”或“=”)
-
(3) 已知:90℃时,水的离子积常数为 Kw=3.8×10-13 , 在此温度下,将 pH=3 的盐酸和 pH=11 的氢氧化钠溶液等体积混合,则混合溶液中的 c(H+)=mol/L(保留三位有效数字)。
-
(4) Ⅱ.常温下,已知 0.1 mol·L-1 一元酸HA 溶液中c(OH-)/c(H+)=1×10-8。常温下,0.1mol·L-1 HA溶液的 pH=;
-
(5) 常温下,向 pH=a 的氨水中加入等体积盐酸时,溶液呈中性,则此盐酸的 pH(14-a)(填写“>”、“<”或“=”)。
-
(1) 煤的气化和液化可以提高燃料的利用率。
已知25℃、101kPa时:
①C(s)+
 O2(g)=CO(g) ΔH=-126.4kJ/mol
O2(g)=CO(g) ΔH=-126.4kJ/mol②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol
③H2O(g)=H2O(l) ΔH=-44kJ/mol
则在25℃、101kPa时:
C(s)+H2O(g)=CO(g)+H2(g) ΔH=。
-
(2) 高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g)
 Fe(s)+CO2(g) ΔH>0
Fe(s)+CO2(g) ΔH>0 已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值(填“增大”“减小”或“不变”)。
②1100℃时测得高炉中,c(CO2)=0.025mol/L,c(CO)=0.1mol/L,则在这种情况下,该反应是否处于化学平衡状态?(填“是”或“否”),其判断依据是。
-
(3) 目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。 现向体积为1L的恒容密闭容器中,充入1molCO2和3molH2 , 反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=。
②下列措施能使
 增大的是(填字母)。
增大的是(填字母)。A.升高温度
B.再充入H2C.再充入CO2
D.将H2O(g)从体系中分离
E.充入He(g),使体系压强增大

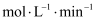 B . 该反应方程式中,
B . 该反应方程式中,  C . 2min时,A的物质的量为
C . 2min时,A的物质的量为  D . 2min时,A的转化率为
D . 2min时,A的转化率为 
-
(1) 已知CH4和S的燃烧热(△H)分别为-890.3 kJ/ mol和一297.2 kJ/ mol , 则CH4 催化还原SO2反应:CH4(g) +2 SO2 (g) =CO2(g)+ 2S(s)+ 2 H2O(1) △H =kJ/mol
-
(2) 在恒容密闭容器中,用 H2还原SO2生成S 的反应分两步完成(如图1所示),该过程中相关物质的物质的量浓度随时间的变化关系如图2所示 :

分析可知X为(填化学式),o~t1时间段的温度为,o~ t1时间段用SO2表示的化学反应速率为。
-
(3) 焦炭催化还原SO2生成S2 , 化学方程式为2C(s)+ 2 SO2 (g)
 S2(g)+2CO2(g)△H < 0。
S2(g)+2CO2(g)△H < 0。 实验测得:v正= k 正c2 (SO2 ) , v逆= k 逆c(S2 ) •c2 ( CO 2) ( k正、k逆为速率常数,只与温度有关).某温度下,向2L的恒容密闭容器中充入1mol SO2 , 并加入足量焦炭,当反应达平衡时,SO2 转化率为80%,则:
①k正:k 逆=。
②若升高温度,k正增大的倍数( 填“> ”、“< ”或“= ”) k 逆增大的倍数。
-
(4) 利用如图所示装置(电极均为惰性电极)可吸收SO2。

直流电源a为极,电解时.电极B的电极反应式为。
 2CO(g)ΔH>0,分别在一定温度下达到化学平衡状态。下列说法正确的是( )
2CO(g)ΔH>0,分别在一定温度下达到化学平衡状态。下列说法正确的是( ) | 容器 | 温度/K | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| n(CO2) | n(C) | n(CO) | n(CO) | ||
| I | 977 | 0.28 | 0.56 | 0 | 0.4 |
| II | 977 | 0.56 | 0.56 | 0 | x |
| III | 1250 | 0 | 0 | 0.56 | y |
-
(1) v(B)= mol·L-1·min-1 , v(C)= mol·L-1·min-1。
-
(2) 在2 min末,C的浓度是 mol·L-1 , B的浓度是 mol·L-1。
-
(1) Ⅰ.已知CO2、C2H6为原料合成C2H4涉及的主要反应如下:
①C2H6(g)
 CH4(g)+H2(g)+C(s)△H1=+9kJ·mol-1
CH4(g)+H2(g)+C(s)△H1=+9kJ·mol-1②C2H4(g)+H2(g)
 C2H6(g)△H2=-136kJ·mol-1
C2H6(g)△H2=-136kJ·mol-1③H2(g)+CO2(g)
 H2O(g)+CO(g)△H3=+41kJ·mol-1
H2O(g)+CO(g)△H3=+41kJ·mol-1④CO2(g)+C2H6(g)
 C2H4(g)+H2O(g)+CO(g)△H4
C2H4(g)+H2O(g)+CO(g)△H4△H4=,0.1MPa时向密闭容器中充入CO2和C2H6 , 发生反应④,温度对催化剂K—Fe—Mn/Si性能的影响如图:

工业生产综合各方面的因素,根据图中的信息判断反应的最佳温度是℃。
-
(2) 在800℃时,n(CO2):n(C2H6)=1:3,充入一定体积的密闭容器中,在有催化剂存在的条件下,发生反应④,初始压强为p0 , 一段时间后达到平衡,产物的总物质的量与剩余反应物的总物质的量相等,则该温度下反应的平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用最简分式表示)。
-
(3) Ⅱ.科学家利用Li4SiO4吸附CO2有着重要的现实意义。CO2的回收及材料再生的原理如图所示:

“吸附”过程中主要反应的化学方程式为。
-
(4) 为了探究Li4SiO4的吸附效果,在刚性容器中放入1000g的Li4SiO4 , 通入10mol不同比例的N2和CO2混合气体,控制反应时间均为2小时,得到Li4SiO4吸附CO2后固体样品质量分数与温度的关系如图所示。

①该反应为反应(填“吸热”或“放热”)。
②保持A点的温度不变,若所用刚性容器体积变为原来的一半,则平衡时c(CO2)较原平衡(填“增大”、“减小”或“不变”)。
③若在A点CO2的吸收率为70%,A点的纵坐标y的值为。
 ,经一段时间后,
,经一段时间后,  的浓度增加了0.8mo/L,在这段时间内用
的浓度增加了0.8mo/L,在这段时间内用  表示的反应速率为
表示的反应速率为  ,则这段时间为( )
,则这段时间为( )
总反应:A +B→AB (K为催化剂)
反应①:A + K → AK Ea1
反应②:AK + B → AB + K Ea2

下列说法正确的是( )
-
(1) 锂电池放电时电池的反应式为。
-
(2) 假设放电过程中消耗负极材料5.6 g,转移的电子数目为(NA为阿伏加德罗常数值)。
-
(3) 已知破坏1 mol H-H键、1 mol O═O键、1mol H-O键时分别需要吸收436 kJ、498 kJ、465 kJ的能量。图表示H2、O2转化为水的反应过程能量变化,则b=。

-
(4) 某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了如下平行实验:

实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示。
实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
①试分析实验①中t1~t2速率增大的主要原因是。t2~t3速率减小的主要原因是。
②实验②放出氢气的量减少的原因是。
③某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?(填“正确”或“不正确”)。请选择下列相应的a或b作答。
a.若不正确,请说明原因。
b.若正确则写出实验③中原电池的正极电极反应式。



