化学反应速率和化学计量数的关系 知识点题库
-
(1) 此反应在四种不同情况下的反应速率分别为:
①v(A)=5mol•L﹣1•min﹣1
②v(B)=6mol•L﹣1•min﹣1
③v(C)=4.5mol•L﹣1•min﹣1
④v(D)=8mol•L﹣1•min﹣1
其中反应速率最快的是 (填编号).
-
(2) 下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同) .A . 容器内压强不再发生变化 B . C的体积分数不再发生变化 C . 容器内气体原子总数不再发生变化 D . 相同时间内消耗2n mol B的同时消耗n molA E . 气体密度保持不变 F . 气体的平均摩尔质量保持不变.
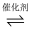 3B(g)+C(g),若反应物在前20s由3mol降为1.8mol,则前20s的平均反应速率为( )
3B(g)+C(g),若反应物在前20s由3mol降为1.8mol,则前20s的平均反应速率为( )
①v(A)=0.15 mol·L-1·s-1
②v(B)=0.6 mol·L-1·s-1
③v(C)=0.4 mol·L-1·s-1
④v(D)=0.45 mol·L-1·min-1
该反应进行的快慢顺序为( )
-
(1) 已知:
CoS2(s) +CO(g)
 CoS(s) +COS(g) ∆H1
CoS(s) +COS(g) ∆H12COS(g) +SO2(g)
 3S(s) +2CO2(g) ∆H2
3S(s) +2CO2(g) ∆H2S(s) +CoS(S)
 CoS2 (s) △H3
CoS2 (s) △H3则2CO(g)+ SO2(g)
 2CO2(g)+S(s) ∆H4=。 (用∆H1、 ∆H2、∆H3表示)
2CO2(g)+S(s) ∆H4=。 (用∆H1、 ∆H2、∆H3表示) -
(2) 在恒温、恒压的容器中模拟回收硫,加入SO2起始量均为1mol,测得CO2的平衡体积分数随CO和SO2的投料比变化如图:

①当投料比为2时,t min 时测得SO2转化率为50%,则用S的生成速率表示的反应速率v=g·min-1。
②当投料比为3时,CO2 的平衡体积分数对应的点是。
-
(3) 向体积均为1L的恒温、恒客密团容器通入2 mol CO和| mol SO2。反应体系总压强随时间的变化如图:
①相对于I,II改变的外界条件是。
②SO2的平衡转化率为,平衡常数Kp =(用平衡分压代替平衡浓度计算)。
-
(4) 利用电解法处理SO2尾气可制备保险粉 (Na2S2O4).电解装置如图,则a b (填“>” “=”或“<”),生成S2O42-的电极反应式为。

 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )

 Z(g)
Z(g)
 2P(g)+2Q(g),改变条件测得化学反应速率如下,其中能符合题意表示反应最快速率的是( )
2P(g)+2Q(g),改变条件测得化学反应速率如下,其中能符合题意表示反应最快速率的是( )
 xC(g)+2D(g),经5min后,测得D的量为1mol,C的平均反应速率是0.1mol/(L·min)。则x的值为( )
xC(g)+2D(g),经5min后,测得D的量为1mol,C的平均反应速率是0.1mol/(L·min)。则x的值为( )
①v(A)=0.45 mol·L-1·min-1
②v(B)=0.6 mol·L-1·s-1
③v(C)=0.4 mol·L-1·s-1
④v(D)=0.5 mol·L-1·s-1
下列有关反应速率的比较中正确的是
 2C(g)+2D(g)的速率如下:
2C(g)+2D(g)的速率如下: ①v(A)=0.15mol∙L-1∙s -1 ②v(B)=0.6mol∙L-1∙s -1
③v(C)=0.5mol∙L-1∙ s -1 ④v(D)=1.2 mol∙L-1∙min -1
其中反应最快的是( )
 经历两步:①
经历两步:①  ;②
;②  。反应体系中
。反应体系中  、
、  、
、  的浓度c随时间t的变化曲线如图所示。下列说法错误的是( )
的浓度c随时间t的变化曲线如图所示。下列说法错误的是( )

 随t的变化曲线
B .
随t的变化曲线
B . 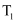 时,
时,  C .
C .  时,
时,  的消耗速率大于生成速率
D .
的消耗速率大于生成速率
D .  后,
后, 
 COS(g)+H2(g)+Q。
COS(g)+H2(g)+Q。完成下列填空:
-
(1) 写出H2S的结构式,它的电离方程式为。
-
(2) 若反应容器的体积为2L,反应前将10mol的CO与一定量的H2S混合加热,20秒后,达到平衡,CO变为8mol,以H2S表示速率,则v(H2S)=mol/(L•s)。
-
(3) 写出一个能表示该反应达到平衡的标志:。
-
(4) 写出一个既能增大H2S转化率,又能加快反应速率的措施:。
-
(5) 该反应在一定条件下的反应速率(v)与时间(t)的关系如图所示,若反应达到平衡时(t1时),升高温度,v正、v逆如何变化,分别用v′正、v′逆表示画在如图。

主反应:
 (环氧乙烷)
(环氧乙烷)
副反应:
已知:
回答下列问题:
-
(1) 乙烯的燃烧热(∆H)为
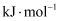 , 该反应每产生
, 该反应每产生 的热量,转移的电子数为
的热量,转移的电子数为 。
。
-
(2) 下列说法正确的是____(填标号)。A . 在主反应中,每消耗
 , 断裂的碳碳键数目为
, 断裂的碳碳键数目为 B . 在副反应中,每消耗
B . 在副反应中,每消耗 同时消耗
同时消耗 , 该反应达到平衡
C . 加入合适的催化剂,主副反应的速率均加快,乙烯的平衡转化率也增大
, 该反应达到平衡
C . 加入合适的催化剂,主副反应的速率均加快,乙烯的平衡转化率也增大
-
(3) 某温度下,在
 的恒容密闭容器中充入
的恒容密闭容器中充入 和
和 后,反应达到平衡,此时测得反应后的总压强与反应前的总压强之比为
后,反应达到平衡,此时测得反应后的总压强与反应前的总压强之比为 的物质的量与总物质的量的比值为
的物质的量与总物质的量的比值为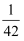 。
。①
 内,
内,
 。
。②
 的转化率为,
的转化率为,
 。
。③反应达到平衡时,主反应的平衡常数K=(写出计算式即可)。
-
(4) 环氧乙烷经水解可得到乙二醇(C2H6O2),写出乙二醇一氧气碱性燃料电池的负极的电极反应式:。



