化学平衡移动原理 知识点题库
一定温度下,在一容积固定的密闭容器中,建立了下列平衡:2NO2 N2O4 , 在此温度下,再向容器通入一定量NO2 , 重新建立平衡后,容器中NO2的体积分数 ( )
N2O4 , 在此温度下,再向容器通入一定量NO2 , 重新建立平衡后,容器中NO2的体积分数 ( )
A . 减少
B . 增大
C . 不变
D . 无法判断变化情况
化学与生产、生活密切相关.对下列现象或事实解释,不正确的是( )
|
选项 |
现象或事实 |
解释 |
|
A |
开启啤酒瓶后会大量冒泡 |
压强减小,气体的溶解平衡向压强增大方向移动 |
|
B |
废旧电池要集中回收处理 |
废旧电池中含有重金属离子,随意丢弃会污染环境 |
|
C |
热碱水清除炊具上残留的油污 |
Na2CO3和油污可直接发生反应 |
|
D |
工业上常用电解法冶炼Na、Mg |
电解池阴极有强还原性 |
A . A
B . B
C . C
D . D
下列事实不能用勒夏特列原理解释的是( )
A . 溴水中有下列平衡Br2+H2O  HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
B . 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C . 反应CO(g)+NO2(g)
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
B . 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C . 反应CO(g)+NO2(g)  CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D . 对于反应2HI(g)
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D . 对于反应2HI(g)  H2(g)+I2 (g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2 (g),达平衡后,缩小容器体积可使体系颜色变深
 HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
B . 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C . 反应CO(g)+NO2(g)
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
B . 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C . 反应CO(g)+NO2(g)  CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D . 对于反应2HI(g)
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D . 对于反应2HI(g)  H2(g)+I2 (g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2 (g),达平衡后,缩小容器体积可使体系颜色变深
利用硅胶作吸附工具有利于将雾霾中的NO转变为NO2。下列有关转化反应2NO+O2 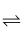 2NO2的说法错误的是( )
2NO2的说法错误的是( )
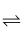 2NO2的说法错误的是( )
2NO2的说法错误的是( )
A . 若增加反应体系的压强,c(NO)将减小
B . v正(NO)=2v正(O2)
C . 该反应的进行是有一定限度的
D . 可将吸附后的硅胶置于水中,通足量空气进行后续处理
下列叙述中,不能用平衡移动原理解释的是( )
A . 红棕色的NO2 , 加压后颜色先变深后变浅
B . 黄绿色的氯水光照后颜色变浅
C . 由H2、Br2(g)、HBr(g)气体组成的平衡体系加压后颜色变深
D . 工业合成氨反应中加压有利于提高氨气的产率
下列生活、生产相关叙述中,不能用勒沙特列原理解释的是( )
A . 工业制硫酸过程中,通入过量的氧气
B . 热的纯碱溶液去油污效果更好
C . 工业制氯化氢时,通入过量的氢气
D . 氨态氮肥与草木灰不能混合使用
根据下列有关图象,说法正确的是( )

A . 由图Ⅰ知,该反应的△H>0
B . 由图Ⅱ知,该反应为放热反应
C . 由图Ⅲ知,t3时一定是采取降低反应温度的措施
D . 由图Ⅲ知,反应在t6时,NH3体积分数最大
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
| 反应时间/min | N(CO)/mol | N(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
下列说法正确的是( )
A . 反应在t1min内的平均速率为v(H2)= 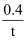 mol•L-1•min
B . 保持其他条件不变,起始时向容器中充入0.60molCO和1.20mol H2O,达到平衡时n(CO2)=0.40mol
C . 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D . 温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
mol•L-1•min
B . 保持其他条件不变,起始时向容器中充入0.60molCO和1.20mol H2O,达到平衡时n(CO2)=0.40mol
C . 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D . 温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
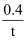 mol•L-1•min
B . 保持其他条件不变,起始时向容器中充入0.60molCO和1.20mol H2O,达到平衡时n(CO2)=0.40mol
C . 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D . 温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
mol•L-1•min
B . 保持其他条件不变,起始时向容器中充入0.60molCO和1.20mol H2O,达到平衡时n(CO2)=0.40mol
C . 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D . 温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
在恒容密闭容器中通入X并发生反应:2X(g)  Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
 Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( ) 
A . 该反应进行到M点放出的热量大于进行到W点放出的热量
B . T2下,在0~t1时间内,υ(Y)=  mol/(L·min)
C . M点的正反应速率υ正大于N点的逆反应速率υ逆
D . M点时再加入一定量的X,平衡后X的转化率减小
mol/(L·min)
C . M点的正反应速率υ正大于N点的逆反应速率υ逆
D . M点时再加入一定量的X,平衡后X的转化率减小
 mol/(L·min)
C . M点的正反应速率υ正大于N点的逆反应速率υ逆
D . M点时再加入一定量的X,平衡后X的转化率减小
mol/(L·min)
C . M点的正反应速率υ正大于N点的逆反应速率υ逆
D . M点时再加入一定量的X,平衡后X的转化率减小
在容器中充入SO2和只由18O原子组成的氧气(18O2)。在一定条件下达到平衡时,18O存在于( )
A . 只存在于O2中
B . 只存在于O2和SO3中
C . 只存在于SO2和SO3中
D . SO3、SO2和O2中都有可能存在
某化学研究小组探究外界条件(压强、温度)对化学反应 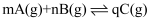 平衡的影响图像如图所示,下列判断正确的是( )
平衡的影响图像如图所示,下列判断正确的是( )
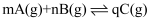 平衡的影响图像如图所示,下列判断正确的是( )
平衡的影响图像如图所示,下列判断正确的是( ) 
A . 由图可知,该反应的正反应为吸热反应
B . 由图可知,若  ,则该反应中
,则该反应中  C . 图中,点
C . 图中,点  和点
和点  的反应速率大小为
的反应速率大小为  D . 当反应达到平衡时,只加入催化剂,
D . 当反应达到平衡时,只加入催化剂,  的百分含量将发生变化
的百分含量将发生变化
 ,则该反应中
,则该反应中  C . 图中,点
C . 图中,点  和点
和点  的反应速率大小为
的反应速率大小为  D . 当反应达到平衡时,只加入催化剂,
D . 当反应达到平衡时,只加入催化剂,  的百分含量将发生变化
的百分含量将发生变化
在某一密闭容器中,若反应  达到平衡后,保持其温度不变,将该密闭容器的体积增加一倍,当达到新的平衡时,则下列说法正确的是( )
达到平衡后,保持其温度不变,将该密闭容器的体积增加一倍,当达到新的平衡时,则下列说法正确的是( )
 达到平衡后,保持其温度不变,将该密闭容器的体积增加一倍,当达到新的平衡时,则下列说法正确的是( )
达到平衡后,保持其温度不变,将该密闭容器的体积增加一倍,当达到新的平衡时,则下列说法正确的是( )
A . 容器内气体密度减小
B . 平衡向正反应方向移动
C . 二氧化氮的转化率增大
D . 四氧化二氮的体积分数增大
某温度时,在密闭容器中,X、Y、Z 三种气体浓度的变化如图Ⅰ所示,若其它条件不变,当温度分别为 T1和 T2时,Y的体积分数与时间关系如图Ⅱ所示。则下列结论正确的是( )
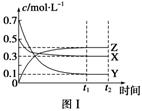
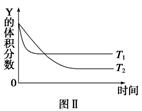
A . 该反应的热化学方程式为 X(g)+3Y(g)⇌ 3Z(g)
B . 达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
C . 若其它条件不变,升高温度,正、逆反应速度均增大,X 的转化率减小
D . 达到平衡后,保持温度体积不变,通入稀有气体,平衡向正反应方向移动
下列实验操作、现象与结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+2KSCN |
| B | 浓度均为0.10mol/L的Na2CO3和Na2S的混合溶液中滴入少量AgNO3溶液 | 产生黑色沉淀 | Ksp(Ag2S)>Ksp(Ag2CO3) |
| C | 向装有X溶液的试管中滴入NaOH溶液,将干燥的红色石蒸试纸置于试管口 | 无明显现象 | X溶液中无NH |
| D | 常温下,向浓度、体积都相同的Na2CO3和NaHCO3溶液中各滴加1滴酚酞 | 变红,前者红色更深 | 结合质子的能力:CO |
A . A
B . B
C . C
D . D
下列事实不能用勒夏特列原理解释的是( )
A . 阴暗处密封有利于氯水的储存
B . 酯化反应中,用过量乙醇提高乙酸转化率
C . 合成氨工业中使用铁触媒做催化剂
D . 热的纯碱溶液比冷的纯碱溶液洗涤油污效果更好
下列事实不能用勒夏特列原理解释的是( )
A . 合成氨时增大压强,有利于提高氨气的产率
B . 实验室常用排饱和食盐水的方法收集氯气
C . 向新制氯水中滴入几滴NaHCO3溶液,可增强溶液的漂白能力
D . 在反应 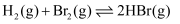 的平衡体系中,增大压强,体系颜色加深
的平衡体系中,增大压强,体系颜色加深
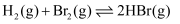 的平衡体系中,增大压强,体系颜色加深
的平衡体系中,增大压强,体系颜色加深
下列说法错误的是( )
A . 将  的
的  溶液加水稀释,
溶液加水稀释,  变大
B . 向
变大
B . 向  的氨水中通氨气,则
的氨水中通氨气,则  的电离程度增大
C .
的电离程度增大
C . 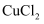 溶液存在
溶液存在  ,向黄绿色的
,向黄绿色的 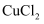 溶液中加水,溶液颜色变蓝
D . 分别向甲容器(恒温恒容)中充入
溶液中加水,溶液颜色变蓝
D . 分别向甲容器(恒温恒容)中充入  ,乙容器(绝热恒容)充入
,乙容器(绝热恒容)充入  和
和  各1mol,发生反应
各1mol,发生反应 
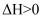 ,平衡时
,平衡时 
 的
的  溶液加水稀释,
溶液加水稀释,  变大
B . 向
变大
B . 向  的氨水中通氨气,则
的氨水中通氨气,则  的电离程度增大
C .
的电离程度增大
C . 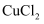 溶液存在
溶液存在  ,向黄绿色的
,向黄绿色的 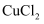 溶液中加水,溶液颜色变蓝
D . 分别向甲容器(恒温恒容)中充入
溶液中加水,溶液颜色变蓝
D . 分别向甲容器(恒温恒容)中充入  ,乙容器(绝热恒容)充入
,乙容器(绝热恒容)充入  和
和  各1mol,发生反应
各1mol,发生反应 
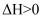 ,平衡时
,平衡时 
现有浓度为0.10 mol·L-1的氨水和 0.10 mol·L-1的 NH4Cl溶液。回答下列问题:
-
(1) 氨水显碱性的原因是(用电离方程式表示)。向氨水中加入 NH4Cl 固体,氨水的电离程度(填“增大”“减小”或“不变”),原因是 ,溶液的 pH(填“增大”“减小”或“不变”)。
-
(2) NH4Cl 溶液显性,原因是(用离子方程式表示)。室温下,若向 NH4Cl溶液中加入少量氨水,使溶液中c(
 )=c(Cl-),则溶液的 pH7(填“>”“<”或“=”)。
)=c(Cl-),则溶液的 pH7(填“>”“<”或“=”)。
-
(3) Mg(OH)2浊液中存在 Mg(OH)2 的沉淀溶解平衡。向此浊液中加入浓的 NH4Cl溶液,观察到的现象是,反应原理是(用离子方程式表示)。
25℃时,三种酸的电离平衡常数如表所示。
|
化学式 |
| HClO | |
| 名称 | 醋酸 | 次氯酸 | 亚磷酸 |
| 电离平衡常数 | | | |
回答下列问题:
-
(1) 浓度均为0.1 mol/L的
 、HClO、
、HClO、  溶液中,
溶液中,  最小的是。
最小的是。
-
(2) 亚磷酸(
 )为二元酸,具有较强还原性的
)为二元酸,具有较强还原性的  是(填“酸式盐”、“碱式盐”或“正盐”),
是(填“酸式盐”、“碱式盐”或“正盐”),  的第二级电离方程式为,此时的电离平衡常数表达式K=。
的第二级电离方程式为,此时的电离平衡常数表达式K=。
-
(3) 体积均为10 mL、
 均为
均为  的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中
的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中  的变化如图所示。则HX的电离平衡常数(填“大于”、“小于”或“等于”)醋酸的电离平衡常数,理由是。
的变化如图所示。则HX的电离平衡常数(填“大于”、“小于”或“等于”)醋酸的电离平衡常数,理由是。 
-
(4)
 相同、等体积的盐酸和醋酸溶液,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的体积相等,则参加反应的锌的物质的量:盐酸(填“>”、“<”或“=”)醋酸,(填“盐酸”或“醋酸”)中有锌剩余。
相同、等体积的盐酸和醋酸溶液,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的体积相等,则参加反应的锌的物质的量:盐酸(填“>”、“<”或“=”)醋酸,(填“盐酸”或“醋酸”)中有锌剩余。
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如下图1表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如下图1表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
 CH3OH(g)+H2O(g),如下图1表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如下图1表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
-
(1) 关于该反应的下列说法中,正确的是____。(填字母)A . △H>0,△S>0 B . △H>0,△S<0 C . △H<0,△S<0 D . △H<0,△S>0

-
(2) 容积一定,下列情况不能说明该反应一定达到平衡的是____ 。A . 混合气体的平均平均相对分子质量不变 B . 混合气体的压强不变 C . 单位时间内生成3mol H—H键,同时生成2 mol H—O键 D . 混合气体中c (CO2) : c (H2) =" 1" : 3
-
(3) 温度降低,平衡常数K(填“增大”、“不变”或“减小”)。
-
(4) 为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2 , 测得CO2和CH3OH (g)的浓度随时间变化如图2所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2)为mol·L-1·min-1 , CO2和H2的转化率比是:
-
(5) 下列措施中能使(4)题中n(CH3OH)/n(CO2)增大的 有____。(填字母)A . 升高温度 B . 加入催化剂 C . 将H2O(g)从体系中分离 D . 充入He(g),使体系总压强增大 E . 再充入1molCO2和3molH2
-
(6) 若在另一个密闭容器中充入1molCO2和3molH2 , 保持压强不变,并使初始体积与题中容器体积相等,且在相同的温度下进行反应,达到平衡时该容器中的CO2的体积百分数(4)题中的CO2的体积百分数。(“>”或“<”或“=”,下同)
最近更新

 >HCO
>HCO 


 ,
, 



