化学平衡移动原理 知识点题库
在一定温度下,容器中加入CO和H2O(g)各1mol,发生反应:CO+H2O CO2+H2 , 达到平衡时生成0.7mol的CO2 , 若其他条件和CO的起始量不变,一开始就加入4mol H2O(g),则达到平衡时生成的CO2可能是( )
CO2+H2 , 达到平衡时生成0.7mol的CO2 , 若其他条件和CO的起始量不变,一开始就加入4mol H2O(g),则达到平衡时生成的CO2可能是( )
 PCl5(g)。达到平衡时,PCl5为0.8mol,如果此时移走2.0molPCl3 和1.0mol Cl2 , 在相同温度下再达到平衡时PCl5的物质的量是( )
PCl5(g)。达到平衡时,PCl5为0.8mol,如果此时移走2.0molPCl3 和1.0mol Cl2 , 在相同温度下再达到平衡时PCl5的物质的量是( )
 C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)  N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是( )
N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是( )
-
(1) 乙烷在一定条件可发生如下反应:C2H6(g)= C2H4(g)+H2(g) ΔH , 相关物质的燃烧热数据如下表所示:
物质
C2H6(g)
C2H4(g)
H2(g)
燃烧热ΔH/( kJ·mol−1)
-1560
-1411
-286
①ΔH=kJ·mol−1。
②提高该反应平衡转化率的方法有、。
③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
-
(2) 高温下,甲烷生成乙烷的反应如下:2CH4
 C2H6+H2。反应在初期阶段的速率方程为:r=k×
C2H6+H2。反应在初期阶段的速率方程为:r=k×  ,其中k为反应速率常数。
,其中k为反应速率常数。
①设反应开始时的反应速率为r1 , 甲烷的转化率为α时的反应速率为r2 , 则r2= r1。
②对于处于初期阶段的该反应,下列说法正确的是。
A.增加甲烷浓度,r增大 B.增加H2浓度,r增大
C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
-
(3) CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:

①阴极上的反应式为。
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的CH4和CO2体积比为。

-
(1) 写出涉及铁化合物的两个离子方程式:;。
-
(2) 25℃时,向0.1mol·L-1的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,从平衡移动的角度解释主要原因是:_。
-
(3) 室温下,如果将0.2molNH4Cl、0.1molNaOH全部溶于水,形成混合溶液(假设无损失)
①和两种粒子的物质的量之和等于0.2mol。
②和两种子的物质的量之和比OH-多0.1mol。
-
(4) 已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能如下四种关系。
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)=c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是,上述离子浓度大小序中正确的是(选填序号)。
②若上述关系中C是正确的,则该溶质的化学式是。
③若该溶液是由体积相等的稀盐酸和氮永混含而成,且恰好呈中性,则混合前c(HCl)(填“>”“<”或“=”,下同)c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)c(Cl-)。
 2NH3(g) △H <0,该反应应采取的适宜条件是( )
2NH3(g) △H <0,该反应应采取的适宜条件是( )
 N2(g)+CO2(g);ΔH=-373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+CO2(g);ΔH=-373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
①电离程度增大 ②c(NH3·H2O)增大 ③NH ![]() 数目增多 ④c(OH-)增大 ⑤导电性增强 ⑥c(H+)增大
数目增多 ④c(OH-)增大 ⑤导电性增强 ⑥c(H+)增大

-
(1) 一种途径是将CO2转化为成为有机物实现碳循环。如:
C2H4 (g) + H2O (l) = C2H5OH (l) ΔH=-44.2 kJ·mol-1
2CO2(g) + 2H2O (l) =C2H4 (g) +3O2(g) ΔH=+1411.0 kJ·mol-1
2CO2(g) + 3H2O (l) = C2H5OH (l) + 3O2(g) ΔH=
-
(2) CO2甲烷化反应是由法国化学家Paul Sabatier 提出的,因此,该反应又叫Sabatier反应。CO2催化氢化制甲烷的研究过程:

①上述过程中,产生H2反应的化学方程式为:。
②HCOOH是CO2转化为CH4的中间体:CO2
 HCOOH
HCOOH  CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉的用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是(填I或II)
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉的用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是(填I或II) -
(3) CO2经催化加氢可以生成低碳烃,主要有两个竞争反应:
反应I:CO2(g) + 4H2 (g)
 CH4 (g) +2H2O(g)
CH4 (g) +2H2O(g)反应II:2CO2(g) + 6H2 (g)
 C2H4 (g) +4H2O(g)
C2H4 (g) +4H2O(g)在1L密闭容器中冲入1molCO2和4molH2,测得平衡时有关物质的物质的量随温度变化如图所示。T1℃时,CO2的转化率为。T1℃时,反应I的平衡常数K=。

-
(4) 已知CO2催化加氢合成乙醇的反应原理为2CO2(g) + 6H2 (g)
 C2H5OH (g) +4H2O(g) ΔH,m代表起始时的投料比,即m=
C2H5OH (g) +4H2O(g) ΔH,m代表起始时的投料比,即m=  .
. 
①图1中投料比相同,温度T3>T2>T1,则ΔH(填“>”或“<”)0.
②m=3时,该反应达到平衡状态后p(总)=20ɑ MPa ,恒压条件下各物质的物质的量分数与温度的关系如图2.则曲线b代表的物质为(填化学式)
-
(1) I.在如图所示的恒温密闭容器中加入2molX和2molY,发生如下反应并达到平衡(X、Y状态未知): 2X(?)+Y(?)⇌aZ(g)。起始时容器的体积为VL,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为VL。

请回答下列问题:
a=;X的状态为(填“气态”或“非气态)
-
(2) 平衡时Y的转化率=
-
(3) 下列叙述中,能说明上述反应达到平衡状态的是(填编号)
a.气体总物质的量不变 b.单位时间内消耗1molY,同时生成amolZ
c.气体的平均摩尔质量保持不变 d.X和Y的物质的量之比保持不变
-
(4) II.某探究性学习小组在20℃进行“碘钟”实验,得到的数据如下表:
实验编号
①
②
③
④
⑤
c(I-)/mol·L-1
0.040
0.080
0.080
0.160
0.120
c(S2O
 )/mol·L-1
)/mol·L-10.040
0.040
0.080
x
0.040

88.0
44.0
22.0
44.0
t1
已知:“碘钟”实验化学方程式为
 ,用
,用  与加入的淀粉溶液显蓝色的时间t来度量反应速率,t越小,反应速率越大。则表中
与加入的淀粉溶液显蓝色的时间t来度量反应速率,t越小,反应速率越大。则表中  的浓度x=,显色时间t1=。
的浓度x=,显色时间t1=。
 W(?)+2Z(g)△H<0.实验过程中部分数据如表所示。
W(?)+2Z(g)△H<0.实验过程中部分数据如表所示。 | 容器 | 起始容积 | 物质的起始加入量 | 平衡时Z的物质的量浓度 |
| 甲 | 2L | 1molX、1molY | 0.6mol·L-1 |
| 乙 | 5L | 2molW、4molZ | 0.48mol·L-1 |
下列说法错误的是( )
| 容器 | 温度(T1>T2) | 起始时物质的量/mol | 平衡时物质的量/mol | |||
| n(Si) | n(HCl) | n(SiCl4) | n(H2) | n(H2) | ||
| Ⅰ | T1 | 0.8 | 0.4 | 0 | 0 | 0.1 |
| Ⅱ | T1 | 0.8 | 0.8 | 0 | 0 | x |
| Ⅲ | T2 | 0 | 0 | 0.1 | 0.2 | y |
 和
和
 , 发生反应:
, 发生反应:
 。
。
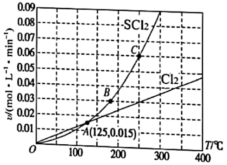
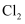 的消耗速率(v)、
的消耗速率(v)、
 的消耗速率(v)、温度(T)三者的关系如图所示,以下说法中不正确的是( )
的消耗速率(v)、温度(T)三者的关系如图所示,以下说法中不正确的是( )
 和
和
 ,
,
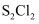 的平衡转化率不变
D . 125℃,平衡时
的平衡转化率不变
D . 125℃,平衡时
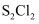 的消耗速率为0.015
的消耗速率为0.015
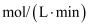
-
(1) 甲醇是新型的汽车动力燃料。工业.上可通过H2和CO化合制备甲醇,该反应的热化学方程式为
2H2(g) + CO(g)
 CH3OH(g) △H1=-116 kJ·mol-1。
CH3OH(g) △H1=-116 kJ·mol-1。已知:CO(g)+
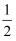 O2(g)=CO2(g) △H2=-283 kJ·mol-1
O2(g)=CO2(g) △H2=-283 kJ·mol-1H2(g)+
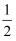 O2(g)=H2O(g) △H3=-242 kJ·mol-1
O2(g)=H2O(g) △H3=-242 kJ·mol-11 mol甲醇气体完全燃烧生成CO2和水蒸气的热化学方程式为。
-
(2) 中科院大连化学物理研究所设计了一种新型多功能复合催化剂,成功地实现了CO2直接加氢制取高辛烷值汽油:5CO2(g)+ 16H2(g)
 C5H12(l)+10H2O(l) △H <0,该研究成果被评价为“CO2催化转化领域的突破性进展”。
C5H12(l)+10H2O(l) △H <0,该研究成果被评价为“CO2催化转化领域的突破性进展”。
向某密闭容器中按一定投料比充入CO2、H2 , 控制条件使其发生反应:5CO2(g)+ 16H2(g)
 C5H12(l)+10H2O(l) △H <0。 测得H2的平衡转化率与温度、压强之间的关系如图所示:则X 表示,Y1Y2(填“>”或“<”)。欲提高H2的平衡转化率并提高单位时间内C5H12(l)的产量,可采取的措施是(写两种)。
C5H12(l)+10H2O(l) △H <0。 测得H2的平衡转化率与温度、压强之间的关系如图所示:则X 表示,Y1Y2(填“>”或“<”)。欲提高H2的平衡转化率并提高单位时间内C5H12(l)的产量,可采取的措施是(写两种)。
-
(3) 利用制备的甲醇可以催化制取丙烯,过程中发生如下反应;3CH3OH(g)
 C3H6(g) + 3H2O(g)。
C3H6(g) + 3H2O(g)。

该反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为Rlnk=
 +C(Ea为活化能,假设受温度影响忽略不计,k为速率常数,R和C为常数)。则该反应的活化能Ea=kJ·mol-1。 当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是;此经验公式说明对于某个基元反应,当升高相同温度时,其活化能越大,反应速率增大得就(填“ 越多”或“越少”)。
+C(Ea为活化能,假设受温度影响忽略不计,k为速率常数,R和C为常数)。则该反应的活化能Ea=kJ·mol-1。 当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是;此经验公式说明对于某个基元反应,当升高相同温度时,其活化能越大,反应速率增大得就(填“ 越多”或“越少”)。 -
(4) 以稀硫酸为电解质溶液,利用太阳能也可将CO2转化为低碳烯烃,工作原理如图所示:

b电极为(填“正极”或“负极”),产生丙烯的电极反应式为。



