焓变和熵变 知识点题库
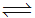 2SO3(g):△H=-197kJ/mol.实验测得4molSO2参加上述反应放出354kJ热量,则SO2的转化率最接近于90%
C . 在Na2SO4溶液中加入过量的BaCl2后,溶液中不存在SO42-
D . 1mol NaOH分别和1mol CH3COOH、1molHNO3反应,后者比前者△H大
2SO3(g):△H=-197kJ/mol.实验测得4molSO2参加上述反应放出354kJ热量,则SO2的转化率最接近于90%
C . 在Na2SO4溶液中加入过量的BaCl2后,溶液中不存在SO42-
D . 1mol NaOH分别和1mol CH3COOH、1molHNO3反应,后者比前者△H大
 时,
时, 
 ,该反应能自发进行的原因是( )
,该反应能自发进行的原因是( ) 
 的值不变
D . 电化学降解NO2的原理如图所示,若电解过程中转移2mol电子,则交换膜两侧电解液的质量变化差△m左-△m右=10.4g
的值不变
D . 电化学降解NO2的原理如图所示,若电解过程中转移2mol电子,则交换膜两侧电解液的质量变化差△m左-△m右=10.4g 
-
(1) 巳知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ·mol-1
C(s)+O2(g)=CO2 △H=-393.5 kJ·mol-1
则汽车尾气处理的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=kJ·mol-1 , 利于该反应自发进行的条件是 (选填“高温”或“低温”)
-
(2) 将0.20 moI NO和0.10mol CO充入一个容积恒定为1L的密闭容器中发生反应:2NO(g)+2CO(g)
 N2(g)+2CO2(g)反应过程中部分物质的浓度变化如下图所示:
N2(g)+2CO2(g)反应过程中部分物质的浓度变化如下图所示: 
①反应从开始到9min时,用CO2表示该反应的速率是(保留2位有效数字)。
②第12min时改变的条件是(填“升温”或“降温”)
③第18min时建立新的平衡,此温度下的平衡常数为(只列计算式),第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将移动(填“正向”、“逆向”或“不”)。
-
(3) 若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在t1时刻达到平衡状态的是 (填序号)。
(如图中V正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)

-
(4) 以氨为燃料可以设计制造氨燃料电池,产物无污染。若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为。
反应①:Hb(aq)+O2(g)  HbO2(aq) ΔH1<0
HbO2(aq) ΔH1<0
反应②:Hb(aq)+CO(g)  HbCO(aq) ΔH2<0
HbCO(aq) ΔH2<0
反应③:HbO2(aq)+CO(g)  HbCO(aq)+O2(g) ΔH3<0
HbCO(aq)+O2(g) ΔH3<0
下列说法错误的是( )
 ,下列说法正确是( )
,下列说法正确是( )

 , 其
, 其 与
与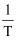 的关系如图所示。下列说法正确的是( )
的关系如图所示。下列说法正确的是( )
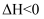 B . 该反应在低温下能自发进行
C . 其他条件相同时,T1比T3时反应先达到平衡状态
D . 若温度在T2时达到平衡后,减压,再次到达平衡状态,CO的浓度增大
B . 该反应在低温下能自发进行
C . 其他条件相同时,T1比T3时反应先达到平衡状态
D . 若温度在T2时达到平衡后,减压,再次到达平衡状态,CO的浓度增大
-
(1) 工业生产氯化物通常用由氧化物经氯化作用生成的方法,例如工业上常采用“加碳氯化”的方法以高钛渣(主要成分为
 )为原料生产
)为原料生产 。
。已知:

 ;
;
 。
。沸腾炉中“加碳氯化”生成
 和
和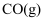 的热化学方程式:。
的热化学方程式:。 -
(2)
 合成有机物时会产生副产物
合成有机物时会产生副产物 。利用反应
。利用反应 可实现氯的循环利用。
可实现氯的循环利用。①该反应的
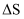 0(填“>”“<”或“=”)。
0(填“>”“<”或“=”)。②若反应物按物质的量
 (
( )在体积不变的密闭容器中发生该反应,下列叙述正确的是(填字母)。
)在体积不变的密闭容器中发生该反应,下列叙述正确的是(填字母)。A.当
 不变时,说明反应已达到平衡状态
不变时,说明反应已达到平衡状态B.当
 时,说明反应已达到平衡状态
时,说明反应已达到平衡状态C.平衡后,继续按
 的物质的量之比投入
的物质的量之比投入 和
和 , 再次达到新平衡时,
, 再次达到新平衡时, 的转化率增大
的转化率增大D.平衡后,分离出
 , 可以提高
, 可以提高 的平衡产率,并加快正反应速率
的平衡产率,并加快正反应速率③下图是在两个不同温度
 和
和 下,改变
下,改变 时
时 在平衡混合物中的体积分数的变化规律曲线。下列叙述正确的是(填字母)。
在平衡混合物中的体积分数的变化规律曲线。下列叙述正确的是(填字母)。
A.a点未达到平衡,c点一定已经平衡
B.平衡常数:

C.达到平衡时
 的转化率大小为a>b>c
的转化率大小为a>b>cD.若平衡常数K值变大,达新平衡前
 始终减小
始终减小 -
(3) 在一定温度下,以
 为催化剂,氯苯(
为催化剂,氯苯( )和
)和 在
在 中发生平行反应,分别生成邻二氯苯(A)和对二氯苯(B),其反应的化学方程式如下:
中发生平行反应,分别生成邻二氯苯(A)和对二氯苯(B),其反应的化学方程式如下:i.

ii.

向盛有
 含有
含有 的
的 的容器中加入
的容器中加入 和
和 发生反应,忽略
发生反应,忽略 溶液体积的变化,达到平衡时生成邻二氯苯(A)和对二氯苯(B)的物质的量(n)随时间(t)变化的曲线如图所示。
溶液体积的变化,达到平衡时生成邻二氯苯(A)和对二氯苯(B)的物质的量(n)随时间(t)变化的曲线如图所示。
①该温度下,反应ii的化学平衡常数
 。
。②工业生产上,提高生成邻二氯苯(A)反应选择性的关键因素是选择合适的。



