常见气体的检验 知识点题库

加热聚丙烯废塑料得到的产物如下表:
产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
质量分数/% | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
-
(1) 试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
A中残留物→聚乙炔
写出反应②③的化学方程式?
-
(2) B中收集得到的物质中能使酸性KMnO4溶液褪色的物质的一氯代物有种。
-
(3) 锥形瓶C中观察到的现象是。经溴水充分吸收,剩余气体经干燥后平均相对分子质量为。
-
(4) 写出C中逸出的气体在工业上的两种用途、。
有一无色气体(可能由O2、N2、CO2、HCl、NH3、H2、NO、NO2中的一种或几种组成),体积为100mL.如图示通过浓硫酸的洗气瓶,发现气体体积减少到一半;通过球形干燥管后气体呈红棕色,再将该气体完全通入盛满水且倒立于水槽的试管内,发现倒立于水槽的试管内的水位下降后又缓慢上升,最后试管内全部充满液体,由此判断:
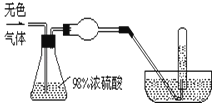
-
(1) )球形干燥管内的固体是 , 反应方程式为
-
(2) 原气体中一定有NH4(50ml)和 (填两种气体),其体积分别是 ;原气体中一定没有
|
选项 |
试剂B |
湿润的试纸A |
现象 |
结论 |
|
A |
新制氯水 |
pH试纸 |
变白 |
氯气具有漂白性 |
|
B |
浓氨水,生石灰 |
蓝色石蕊试纸 |
变红 |
氨气显碱性 |
|
C |
Na2SO3 , 硫酸 |
品红试纸 |
褪色 |
SO2具有漂白性 |
|
D |
Cu,浓硝酸 |
KI淀粉试纸 |
变蓝 |
NO2为酸性气体 |

①澄清的石灰水(无浑浊);
②氢氧化钡溶液(有混浊现象);
③浓硫酸(无明显现象);
④灼热的氧化铜(变红);
⑤无水硫酸铜(变蓝).
下列对该混合气体成分的判断正确的是( )


-
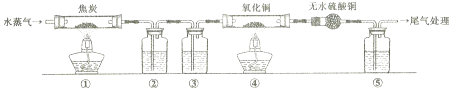
(1) 哪个学生设计的装置比较合理?(填“甲”或“乙”),另一设计装置不合理的原因
-
(2) 用比较合理的装置制取氢气,要使氢气充满收集氢气的试管,应该采取的措施是。
-
(3) 还可以用哪些常见物品和试剂代替废牙膏皮和氢氧化钠溶液完成实验?
-
(4) 测定H2和空气混合气体的爆炸范围实验如下所述。取10支大试管,依次盛水90%(体积分数)、80%……再用排水集气法收集H2 , 而后分别把试管口移近酒精灯火焰,实验结果如下:
H2体积分数/%
90
80
70
60~20
10
5
空气体积分数/%
10
20
30
40~80
90
95
点燃现象
安静
燃烧
安静
燃烧
弱爆炸
强爆炸
弱爆炸
不燃烧
不爆炸
由上述实验结果评价:用向下排空气法收集H2 , 保持试管倒置移近火焰,如果只发出轻微的“噗声”,表示收集的H2已纯净的说法的真正涵义:。
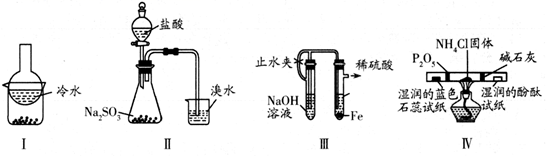

 :先加盐酸,再加BaCl2溶液
C . 检验NH3:用蘸有浓硫酸的玻璃棒靠近打开的瓶口
D . 检验
:先加盐酸,再加BaCl2溶液
C . 检验NH3:用蘸有浓硫酸的玻璃棒靠近打开的瓶口
D . 检验  :加入苛性钠溶液,加热,用湿润的红色石蕊试纸在试管口检验
:加入苛性钠溶液,加热,用湿润的红色石蕊试纸在试管口检验
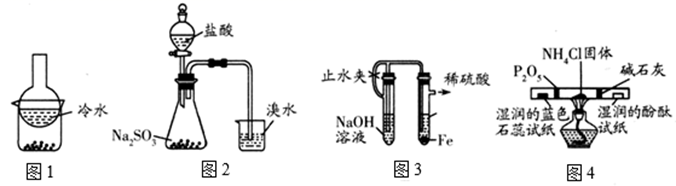
 溶液与
溶液与 的反应。
的反应。
-
(1) I.如下图所示制备
 (经检验装置气密性良好)。
(经检验装置气密性良好)。
仪器a的名称是。
-
(2) 写出C中制备
 的离子方程式。
的离子方程式。
-
(3) II.探究
 溶液与
溶液与 的反应,过程如下图所示:
的反应,过程如下图所示:
已知:硫酸亚铜易溶于水。
回答下列问题:
加入
 固体后产生的无色气体经检验为
固体后产生的无色气体经检验为 , 写出该检验的实验操作及现象:。(可选试剂:
, 写出该检验的实验操作及现象:。(可选试剂: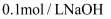 溶液、
溶液、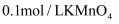 溶液、碘水)
溶液、碘水) -
(4) 加入
 固体后产生的白色沉淀经检验是
固体后产生的白色沉淀经检验是 , 说明发生了氧化还原反应。加入
, 说明发生了氧化还原反应。加入 固体发生反应的原因:
固体发生反应的原因:a.
 改变了
改变了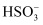 的还原性
的还原性b.
 改变了的
改变了的 的氧化性
的氧化性用原电池原理进行实验,探究上述可能的原因。
编号
实验1
实验2
实验
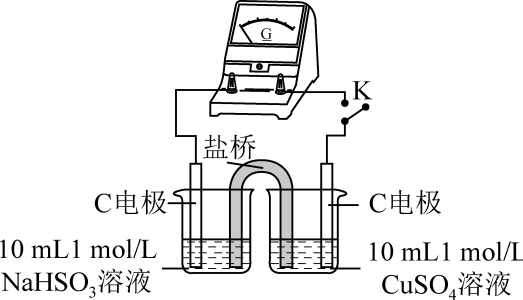
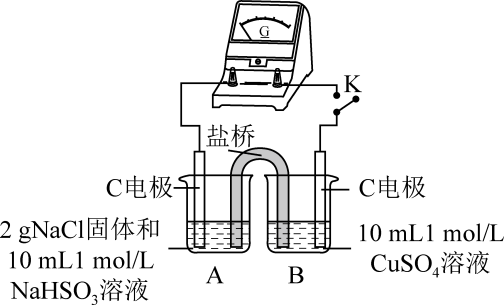
现象
闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象
闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象
①由实验1、2可知原因a不合理,依据是。
②实验3:用下图所示装置实验,B中有白色沉淀生成,证明原因b合理。
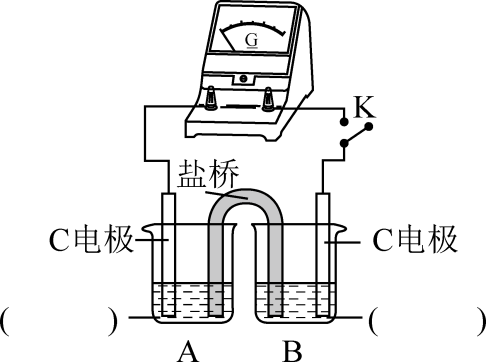
ⅰ.补全上图电化学装置示意图:。
ⅱ.写出B中的电极反应方程式。
ⅲ.请从反应原理的角度解释原因:
 与
与 的还原产物
的还原产物 形成沉淀,,使
形成沉淀,,使 与
与 的反应能够进行完全。
的反应能够进行完全。 -
(5) III.金能与浓硝酸发生微弱反应生成
 , 短时间几乎观察不到金溶解。金易溶于“王水”[V(浓硝酸):V(浓盐酸)
, 短时间几乎观察不到金溶解。金易溶于“王水”[V(浓硝酸):V(浓盐酸)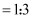 ]。
]。已知:

利用(4)中实验探究的结论,分析“王水”溶金的原理:。
选项 | 实验操作 | 现象 | 解释或结论 |
A | 加热NaI固体和浓磷酸的混合物 | 有气体产生 | 生成了HI气体 |
B | 取等物质的量的Al和Fe,分别与足量的稀盐酸反应 | Al产生的氢气多 | 金属性:Al>Fe |
C | 向苯酚浊液中滴加饱和Na2CO3溶液 | 浊液变澄清 | 酸性:苯酚>碳酸 |
D | 分别在20℃、30℃下,取0.1mol·L-1KI溶液,向其中先加入0.1mol·L-1的硫酸,再加入淀粉溶液,发生反应4H++O2+4I-=2I2+2H2O | 30℃下出现蓝色的时间短 | 探究反应速率与温度的关系 |
| 选项 | 检验括号中的物质 | 检验试剂 |
| A | CO2气体(H2S) | CuSO4溶液 |
| B | Na2SO3溶液(Na2SO4) | BaCl2溶液 |
| C | 海水(KI) | 淀粉溶液 |
| D | 乙醇(水) | 金属钠 |



