二价铁离子和三价铁离子的检验 知识点题库
 Fe3+
Fe3+  FeO
FeO  (高铁酸根离子)回答下列有关问题:
(高铁酸根离子)回答下列有关问题:
-
(1) 检验硫酸铁溶液中是否存在Fe2+的方法是.
-
(2) 干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑
该反应中的还原剂是,每生成1mol Na2FeO4转移 mol电子.
-
(3) 湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO﹣、OH﹣、FeO42﹣、Cl﹣、H2O.
①写出并配平湿法制高铁酸钾的离子反应方程式:.
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为.
选项 | 实验操作及实验现象 | 结论 |
A | 室温下,用pH试纸分别测定浓度为0.1 mol·L-1NaClO溶液和0.1 mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
B | 向某溶液中滴加KSCN溶液,无明显现象,再滴加少量酸性高锰酸钾溶液,紫色褪去 | 溶液中含有Fe2+ , 不含Fe3+ |
C | 取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体,此气体能使澄清石灰水变浑浊 | Na2O2已经变质 |
D | 向浓度均为0.1 mol·L-1NaCl和Na2CrO4混合溶液中滴加0.1 mol·L-1AgNO3溶液,先生成白色的AgCl沉淀 | Ksp(AgCl)<Ksp(Ag2CrO4) |

-
(1) ①若装置A中的试管不加热,则没有明显现象,原因是。
②证明有SO2 生成的现象是;为了证明气体中含有氢气,装置B和C中加入的试剂分别为X、CuSO4 , 请写出装置B处反应的化学方程式。
-
(2) 取装置A试管中的溶液6mL,加入适量氯水恰好反应,再加入过量的KI溶液后,分别取2mL此溶液于3支小试管中进行如下实验:
①第一支试管中加入1mLCCl4 , 充分振荡、静置,CCl4层呈紫色;
②第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有(填离子符号),由此可以证明该离子与I-发生的氧化还原反应为。
-
(3) 向盛有H2O2溶液的试管中加入几滴装置A试管中的溶液,溶液变成棕黄色,发生反应的离子方程式为;一段时间后,溶液中有气泡出现并放热,随后有红褐色沉淀生成。产生气泡的原因是;生成沉淀的原因是 (用平衡移动原理解释)。
| 选项 | 被检验的物质 | 使用的试剂或方法 | 实验现象 |
| A | Fe3+ | KSCN溶液 | 溶液出现血红色沉淀 |
| B | SO2 | 品红溶液 | 品红溶液褪色,加热不能复原 |
| C | Na+ | 用铂丝蘸取少量溶液在火焰上灼烧 | 透过蓝色钴玻璃看到紫色火焰 |
| D | NH4+ | NaOH溶液、石蕊试纸 | 加入NaOH溶液后加热,产生的气体使湿润的红色石蕊试纸变蓝 |

请回答下列问题:
-
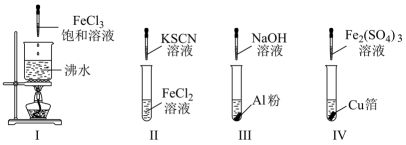
(1) FeCl3溶液腐蚀铜箔反应的离子方程式为。
-
(2) 固体A的成分是,气体C的化学式为。
-
(3) 设计实验方案证明FeCl3溶液中的金属阳离子。
-
(4) 反应消耗铁粉11.2g,则废液中Fe3+的物质的量浓度是。

回答下列问题:
-
(1) “酸浸”时需要将钛铁矿粉碎,其目的是。
-
(2) 浸出液呈强酸性,含有TiO2+、Fe2+及少量Fe3+、Al3+等离子,则生成TiO2+的离子方程式是。
-
(3) “反应”时需加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是。
-
(4) 通过控制条件,可以使过程①中生成的TiO2·nH2O形成一种液态分散系,用一束光照射该分散系能够产生丁达尔效应,则分散质颗粒直径的范围是。
-
(5) 过程①制得的固体TiO2·nH2O需用过量酸清洗以除去其中的Fe(OH)3杂质,检验Fe(OH)3杂质除净的实验方法是。
-
(6) 过程③生成的废气中含有CO,则TiO2和焦炭、氯气在高温下发生反应的化学方程式是。
-
(7) 上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是(只要求写出一项)。
-
(8) 依据表中信息,可采用方法精制含少量SiCl4杂质的TiCl4。
TiCl4
SiCl4
熔点/℃
-25.0
-68.8
沸点/℃
136.4
57.6
 Fe2(SO4)3+3SO2↑+6H2O。某学习小组对铁丝(含杂质碳)与浓硫酸反应后的产物进行探究。
Fe2(SO4)3+3SO2↑+6H2O。某学习小组对铁丝(含杂质碳)与浓硫酸反应后的产物进行探究。 
-
(1) Ⅰ.溶液探究
将反应后的溶液稀释,取稀释液,滴加NaOH溶液,观察到现象时,证明有Fe3+存在。为进一步判断溶液中是否存在Fe2+ , 可另取稀释液少许,滴加(选填编号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.KMnO4酸性溶液
-
(2) 为判断反应停止后硫酸是否有剩余,制定的实验方案为:测定稀释液的pH。请对此实验设计进行评价。。
-
(3) Ⅱ.气体探究
将产生的气体依次通过品红溶液和澄清石灰水,观察到:品红溶液褪色、澄清石灰水变浑浊。是否(填写“是”或“否”)能据此判断除SO2外,反应后气体中还含有CO2?请说明理由。
最后逸出的气体具有可燃性,推测该气体为H2 , 理由是(用离子方程式表示)。
-
(4) 收集混合气体336mL(已折算成标准状况),通入足量的氯水中,发生反应:SO2+Cl2+2H2O=H2SO4+2HCl。滴加足量BaCl2溶液,生成的沉淀经过滤、洗涤、干燥、称量,测得质量为2.330g。则混合气体中SO2的体积分数为。(精确至小数点后第二位)
-
(5) 将上述混合气体直接通入BaCl2溶液,未见明显现象,放置一段时间后发现有少许浑浊,分析其中的原因。
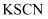 溶液,溶液变为红色,该溶液中一定存在
溶液,溶液变为红色,该溶液中一定存在  B . 加入稀盐酸,产生能使澄清石灰水变浑浊的气体,该溶液中一定存在
B . 加入稀盐酸,产生能使澄清石灰水变浑浊的气体,该溶液中一定存在  C . 滴加
C . 滴加  溶液产生白色沉淀,再加稀硝酸沉淀不溶解,该溶液中一定存在
溶液产生白色沉淀,再加稀硝酸沉淀不溶解,该溶液中一定存在  或
或  D . 加入足量浓
D . 加入足量浓  溶液、加热,产生有刺激性气味且能使湿润红色石蕊试纸变蓝的气体,该溶液中一定存在
溶液、加热,产生有刺激性气味且能使湿润红色石蕊试纸变蓝的气体,该溶液中一定存在 
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将少量浓硝酸分多次加入Cu和稀硫酸的混合物中 | 产生红棕色气体 | 硝酸的还原产物为NO2 |
| B | 将少量Fe(NO3)2试样加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液 | 溶液变成血红色 | Fe(NO3)2试样无法确定是否变质 |
| C | 2滴0.1mol·L−1 MgCl2溶液中滴加2ml 1mol·L−1 NaOH溶液,再滴加2滴0.1 mol·L−1 FeCl3溶液 | 先生成白色沉淀,后生成红褐色沉淀 | Ksp[Mg(OH)2]> Ksp[Fe(OH)3] |
| D | 将溴乙烷和NaOH乙醇溶液混合加热,产生的气体通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色 | 产生了乙烯 |
 C . 向浸取液中加入KSCN溶液,无明显现象,滴入新制氯水后,溶液变为红色,说明雾霾中Fe2+
D . 向浸取液中加入浓NaOH溶液微热,试管口附近湿润的红色石蕊试纸变蓝,说明雾霾中一定含有
C . 向浸取液中加入KSCN溶液,无明显现象,滴入新制氯水后,溶液变为红色,说明雾霾中Fe2+
D . 向浸取液中加入浓NaOH溶液微热,试管口附近湿润的红色石蕊试纸变蓝,说明雾霾中一定含有 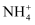
-
(1) 某小组在探究Fe2+性质的实验中观察到异常现象(实验1),观察到溶液变红,片刻红色褪去,有气体生成(经检验为O2)。
①在实验1加入H2O2溶液与Fe2+反应的离子方程式是,溶液变红的离子方程式是。

②用实验2探究“红色褪去”的原因,则红色褪去的原因是。

-
(2) Ⅱ.钒性能优良,用途广泛,有金属“维生素”之称。完成下列填空:将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应后生成VO2+、
 , 该反应的化学方程式是。
, 该反应的化学方程式是。
-
(3) 向上述所得溶液中加入KClO3溶液,完善并配平反应的离子方程式。
 ClO
ClO +
+ VO2++
VO2++ _=
_= Cl-+
Cl-+ VO
VO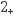 +
+ _
_ -
(4) V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应被吸收,则SO
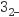 、Cl-、VO2+还原性由大到小的顺序是。
、Cl-、VO2+还原性由大到小的顺序是。
-
(5) 在20.00mL0.1mol/LVO
 溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是。
溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是。a.VO2+ b. VO+ c. V2+ d.V

已知:Fe2+与K3[Fe(CN)6]溶液反应生成特征蓝色沉淀,Fe3+不会。
请回答:
-
(1) 铁合金在生活中应用广泛,铁合金属于(填字母)。
a.金属材料 b.高分子材料
-
(2) 写出铁和水蒸气反应的化学方程式。
-
(3) 加入足量CuSO4溶液,充分反应后过滤、洗涤的目的是(答两点)。
-
(4) 试剂A和实验现象a,试剂B和实验现象b分别是。
选项 | 实验操作 | 现象 | 结论 |
A | 向某溶液中加入稀盐酸酸化,再加入BaCl2溶液 | 酸化后溶液中无现象,再加溶液后观察到有白色沉淀生成 | 该溶液中存在SO |
B | 向苯酚浊液中加入Na2CO3溶液 | 溶液变澄清 | 酸性:苯酚>碳酸 |
C | 用洁净的铂丝蘸取某溶液进行焰色反应 | 焰色呈黄色 | 该溶液为钠盐溶液 |
D | 向FeCl2溶液中滴加KSCN溶液 | 溶液变红 | FeCl2已完全变质 |
 离子
离子


