二价铁离子和三价铁离子的检验 知识点题库
①过量的Fe与Cl2反应
②Fe和过量稀硫酸反应
③FeCl2溶液中通入少量Cl2
④Fe和Fe2O3的混合物溶于盐酸中
⑤向Fe(NO3)2溶液中加入过量稀硫酸.
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SO2有漂白性 | SO2可使溴水褪色 |
B | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性:S>C |
C | 向铁和稀硝酸反应后的漭液中若滴加KSCN溶液显红色:若滴加酸性高锰酸钾溶液紫红色褪去 | 该溶液中既有Fe3+ , 还有Fe2+ |
D | 浓硫酸有脱水性 | 浓硫酸可用于干燥H2和CO |

回答下列问题:
-
(1) 在95 ℃“溶侵”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为。
-
(2) “滤渣1”的主要成分有。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是。
-
(3) 根据H3BO3的解离反应:H3BO3+H2O
 H++B(OH)−4 , Ka=5.81×10−10 , 可判断H3BO3是酸;在“过滤2”前,将溶液pH调节至3.5,目的是。
H++B(OH)−4 , Ka=5.81×10−10 , 可判断H3BO3是酸;在“过滤2”前,将溶液pH调节至3.5,目的是。
-
(4) 在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为,母液经加热后可返回工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是。
-
(1) ①只含上述某一种元素的常见化合物中,呈淡黄色的是(填化学式)。
②焰色反应的实验中,Na元素燃烧时的焰色为色,观察 K元素燃烧时的焰色需要透过。
③实验室在制备 Fe(OH)2时必须隔绝空气,否则发生的现象是。 反应化学方程式为。
-
(2) 饮用水质量是关系人类健康的重要问题。
①氯气是最早用于饮用水消毒的物质,其消毒作用主要是氯气溶于水后生成了次氯酸,该反应的离子方程式为:。
②写出工业上制取漂白粉的化学反应方程式:。
③ClO2是一种广谱型的消毒剂,将逐渐取代 Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加 H2SO4酸化后反应制得,反应中 NaClO3和Na2SO3的物质的量之比为。
![]()
-
(1) 写出加入过量①时FeCl3溶液发生反应的离子方程式:。
-
(2) 检验废腐蚀液中是否含有Fe3+所需试剂名称:,反应的离子方程式为:。
-
(3) 向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:,此转化的化学方程式为:。
-
(4) 通入⑥发生反应的离子方程式:。通入⑥的反应还可以改用加入过氧化氢和稀盐酸的方法,则发生反应的离子方程式:。
| 选项 | 操作和现象 | 结论或目的 |
| A | 将饱和的 | 制备 |
| B | 向钠与水反应形成的溶液中滴加几滴酚酞,溶液变红 | 钠与水反应生成了碱 |
| C | 向 | 沉淀为 |
| D | 向某溶液中通入 | 原溶液中一定含有 |
| 操 作 | 现 象 | 结 论 | |
| A | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| B | 将稀硝酸加入过量铁粉中,充分反应后再滴加KSCN溶液 | 有气体生成,溶液不呈血红色 | 稀硝酸将Fe氧化为Fe2+ |
| C | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状炭 | 浓硫酸具有吸水性 |
| D | 向5 mL KI溶液中加入1 mL相同浓度FeCl3溶液,充分反应后滴入KSCN溶液 | 溶液变血红色 | KI与FeCl3的反应有一定限度 |

已知:D为无色、有刺激性气味的有毒气体。请回答:
-
(1) X中含有的元素为H、O、;X的化学式为;
-
(2) 下列说法错误的是___________;A . 固体A的分解为氧化还原反应 B . 固体C具有磁性,俗称磁性氧化铁 C . 气体D和E均为共价化合物 D . 溶液F具有强酸性
-
(3) 写出F →G的离子方程式;
-
(4) D在适当的温度并有催化剂存在的条件下,可以被氧气氧化,生成E。写出D→E的化学方程式;
-
(5) 另设计实验方案,用化学方法检验固体A中的阳离子。
| 选项 | 实验操作和现象 | 结论 |
| A | 将一块镁片与一块铝片经电流表用导线连接,浸入NaOH溶液中,铝片逐渐溶解,电流表指针偏向镁片 | 铝片为负极 |
| B | 将 | |
| C | 将盐酸滴加到 | 非金属性:Cl>S |
| D | 往淀粉溶液中加入少量稀硫酸,加热。待溶液冷却后加入NaOH溶液调至碱性,再加入少量新制 | 淀粉完全水解 |
| 选项 | 实验操作和现象 | 结论 |
| A | 向溶液X中加入Na2O2粉末,出现红褐色沉淀和无色气体 | X中不一定含有Fe3+ |
| B | 常温下,测得0.1mol/LNaA溶液的pH小于0.1mol/LNa2CO3溶液的pH | 酸性:HA>H2CO3 |
| C | 将铝与氧化铁发生铝热反应后的熔融物在稀盐酸中充分溶解,再滴加几滴KSCN溶液,溶液未变红 | 熔融物中不含有+3价铁 |
| D | 向2支均盛有2mL1.0mol·L-1KOH溶液的试管中分别加入2滴浓度均为0.1mol·L-1的AlCl3和MgCl2溶液,一支试管出现白色沉淀,另一支无明显现象 | Ksp[Al(OH)3]>Ksp[Mg(OH)2] |
 晶体。具体的流程如下:
晶体。具体的流程如下: 
试回答下列问题:
-
(1) 提高“酸溶”的速率的方法是:。
-
(2) 蒸发过程中需要用到玻璃棒,此时玻璃棒的作用是。
-
(3) 过滤时,需要用到的玻璃仪器是:烧杯、、,过滤后所得滤渣的主要成分是:。
-
(4) “氧化”过程中发生反应的离子方程式为,该反应中氧化剂是。
-
(5) “氧化”过程结束后,如何证明溶液中有
 存在?请写出实验方案:。
存在?请写出实验方案:。
| 编号 | 实验目的 | 实验过程 |
| A | 检验FeCl2溶液中的Fe2+ | 取少量样品溶液于试管,加入少量酸性KMnO4溶液 |
| B | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和FeCl3溶液中 |
| C | 制取干燥纯净的氢气 | 向稀盐酸中加入锌粒,将生成的气体依次通过浓硫酸、NaOH溶液,然后收集 |
| D | 探究维生素C的还原性 | 向盛有2mL氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
操作 | 现象及产物检验 |
5mL 0.5mol﹒L-1 FeCl3溶液[pH约为1,即c(H+)=0.1mol﹒L-1] | 立即产生大量气泡,液体颜色由黄色逐渐变为红褐色,此时检测到溶液中存在Fe2+ , 镁条表面仍为光亮的银白色;一段时间后,底部有红褐色沉淀,溶液颜色接近无色,金属表面产生大量黑色固体 |
-
(1) 产生的气体是。
-
(2) 开始反应后,立即检测到溶液中含有Fe2+的原因是(用离子方程式表示)。
-
(3) 生成的红褐色沉淀是。
-
(4) 反应后,最终溶液呈无色。甲同学认为上层清液中仍然可能存在Fe2+ , 并设计如下方案:取上层清液于试管中,滴加酸性KMnO4溶液,若紫色褪去,则说明上层清液中含有Fe2+。乙同学认为该方案不合理,其理由是。最终乙同学利用Fe2+的特征反应证实了溶液中存在Fe2+。
-
(5) 已知Fe和Fe3O4都能被磁铁吸引,分离出黑色固体,经下列实验证实了其中含有的主要物质。
ⅰ.黑色固体可以被磁铁吸引;
ⅱ.将黑色固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
ⅲ.向ⅱ反应后的溶液中滴加KSCN溶液,无变化。
a.黑色固体中一定含有的物质是。
b.小组同学认为上述实验无法确定黑色固体中是否含有Fe3O4 , 理由是。
-
(1) 实验室沿用舍勒的方法制取Cl2的化学方程式为。
-
(2) 实验室制取干燥Cl2时,净化与收集Cl2所需装置的接口连接顺序为。
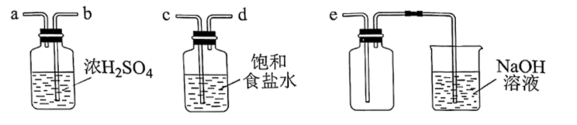
-
(3) 新制氯水呈黄绿色是由于其中含有。Cl2与H2O反应的化学方程式为。
-
(4) 某实验小组探究新制氯水与铁的反应。实验操作过程及实验现象如图所示。

①实验i中产生少量无色无味气体,该反应的离子方程式是。
②实验ii中观察到溶液变为红色,可推知上层清液中含有Fe3+ , 该试剂X是。
③实验iii中观察到溶液无明显变化,可推知上层清液中不含Fe3+ , 其原因是(用离子方程式表示)。
④甲同学认为上层清液中的Fe3+是由Cl2与Fe2+反应生成。乙同学认为还有其他可能性,请列举其中一种可能性。
 Fe2O3+SO3↑+SO2↑+14H2O。某研究性学习小组用如图所示装置对绿矾进行焙烧,并检验其焙烧产物。请回答下列问题:
Fe2O3+SO3↑+SO2↑+14H2O。某研究性学习小组用如图所示装置对绿矾进行焙烧,并检验其焙烧产物。请回答下列问题:
![]()
-
(1) 装置C的作用是;
-
(2) 装置D可以观察到的实验现象是;
-
(3) 装置E的作用是除去多余的SO2 , 请写出该反应的离子方程式。
-
(4) 实验结束后,请设计一个实验方案检验装置A中生成的固体产物(不考虑其他反应)。
-
(5) 下列说法正确的是____A . 装置B中所加的试剂为P2O5 B . 为了让实验结果更准确,实验开始前应先通一段时间的N2 , 以排尽装置中的空气 C . 实验操作的顺序为:先组装装置,然后加入各种试剂,再检查气密性,最后点燃酒精喷灯开始实验 D . 若要除去FeSO4溶液中混有的Fe2(SO4)3杂质,可向溶液中加入过量的铁粉,充分反应后,过滤即可
 溶液滴加到浓
溶液滴加到浓  溶液中
溶液中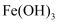 胶体
胶体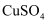 溶液中加入一小块钠,生成气体和沉淀
溶液中加入一小块钠,生成气体和沉淀
 ,再加入
,再加入 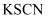 溶液,溶液变红色
溶液,溶液变红色
 样品溶于稀硫酸后,滴加KSCN溶液,溶液变红色
样品溶于稀硫酸后,滴加KSCN溶液,溶液变红色 固体中,把产生的气体通入品红溶液,品红溶液褪色
固体中,把产生的气体通入品红溶液,品红溶液褪色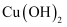 ,继续加热,生成砖红色沉淀
,继续加热,生成砖红色沉淀



