性质实验方案的设计 知识点题库

-
(1) 如图1是中学化学中常用于混合物分离和提纯的装置,请回答问题:
①用CCl4可以从碘水中提取碘,该分离方法的名称为,应选择下图中装置.
②从氯化钠溶液中得到氯化钠固体,应选择下图中的装置.
③装置丁中仪器B的名称是,冷水进水方向:从(填“e”或“f”)口进水.
④乙、丙中玻璃棒的作用分别是.
-
(2) 已知:加热条件下,氨和氧化铜可以发生反应:2NH3+3CuO
 3Cu+N2+3H2O反应可以在如图2装置中进行.请回答下列问题:
3Cu+N2+3H2O反应可以在如图2装置中进行.请回答下列问题: ①A中可采用实验室制法来制取氨,化学方程式为.
②B中加入的干燥剂可选用(填代号).a 碱石灰 b无水氯化钙 c 浓硫酸
③能证明氨与氧化铜反应的现象是:C中;D中.

|
物质 |
乙醛 |
乙酸 |
甘油 |
乙醇 |
水 |
|
沸点 |
20.8℃ |
117.9℃ |
290℃ |
78.5℃ |
100℃ |
请回答下列问题:
-
(1) 试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件);
-
(2) 如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A 的反应液中,目的是;当试管A内的主要反应完成后温度计水银球的位置应在略低于试管A 的支管口处,目的是
-
(3) 烧杯B的作用是使试管A内的反应液均匀受热发生反应,烧杯B内盛装的液体可以是(在题给物质中找);
-
(4) 若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案.所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末.实验仪器任选.该方案为.
-
(1) I.汽车尾气(含有烃类、CO、SO2与NO等物质),冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂).它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化.写出一氧化碳与一氧化氮反应的化学方程式:
Ⅱ.课题组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如图实验装置.请回答:

B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为;C中反应的离子方程式为.
-
(2) 为了实现绿色环保的目标,制取SO2装置最好选择.(A1或A2装置)用氨水吸收尾气中的SO2 , “吸收液”中可能含有OH﹣、SO32﹣、SO42﹣、HSO3﹣等阴离子.请回答:
-
(3) 氨水吸收过量SO2的反应的离子方程式为
-
(4) 已知亚硫酸氢盐一般易溶于水,SO2也易溶于水.现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/LHNO3、1mol/LBaCl2溶液、1mol/LBa(OH)2溶液、品红溶液、蒸馏水.请设计实验证明“吸收液”中存在SO32﹣、HSO3﹣ , 完成下表的实验操作、预期现象和结论:
实验操作
预期现象与结论
步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量.
若出现白色浑浊,则溶液中存在SO32﹣或 SO42﹣ .
步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体.
步骤3:

-
(1) 写出试管甲中所发生反应的化学反应方式.
试管乙口部浸有碱液的棉花其作用是.
-
(2) 试管甲中溶液变为色,乙中品红溶液等现象,说明了铜和浓硫酸发生了化学反应,并且该现象还能说明产生的气体具有性.
-
(3) SO2的排放是造成酸雨的主要因素,为了减少SO2的排放,常用石灰(CaO)法对煤燃烧后的烟气脱硫,其原理是(用化学方程式表示).
-
(4) SO2在适当的温度并有一定催化剂存在的条件下可以转化为SO3 , 其化学方程式为.
-
(5) 为防止二氧化硫造成空气污染,如果需要在装置末端增加尾气吸收装置,应选择的装置是(填“B”或“C”).
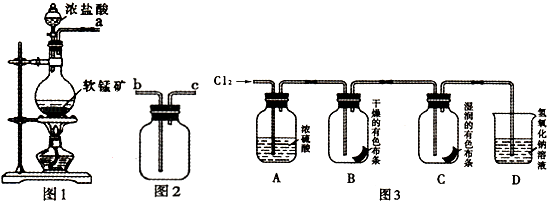
【查阅资料】MnO2+4HCl(浓)  MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
-
(1) 【制取气体】
取适量矿样置于烧瓶中,加入足量浓盐酸并加热,充分反应后烧瓶中残留的固体是.
-
(2) 收集氯气应将图1导管的a接口与图2导管的接口连接(填“b”或“c).
-
(3) 若生成标准状况下11.2L Cl2 , 则参加反应的MnO2的物质的量为 mol.
-
(4) 【实验探究】
把红热的铁丝伸入盛有氯气的集气瓶中,铁丝燃烧产生棕褐色的烟.反应的化学方程是.
-
(5) 按图3进行实验,观察到B中的有色布条不褪色,C中的有色布条褪色.由此得出的结论.
-
(6) 写出C中反应的化学方程式:.
-
(7) 【联系实际】
某氯碱工厂的氯气管道发生泄漏,以下采取的措施正确的是 (填序号).
A . 将人群向高处疏散 B . 将人群向低处疏散 C . 关闭氯气管道,用碱液浸泡过的棉布覆盖泄漏部位 D . 关闭氯气管道,用饱和NaCl溶液浸泡过的棉布覆盖泄漏部位.
-
(1) 在下图装置中进行实验,向a中加入0.5mol·L-1CuSO4溶液50mL和5mol·L-1NaOH 溶液100mL,振荡,再加入40%的甲醛溶液50mL,缓慢加热20分钟后冷却至室温。

仪器a、b的名称分别是、。
-
(2) 上述实验有副反应发生,产生的气体为CO、H2中的一种或两种。为确认气体成分,将装置A 和如下图所示装置连接后进行实验。

依次连接的合理顺序为A→→→→→→G。副产物中如果有CO,实验现象是:。
-
(3) 已知HCHO 最终被氧化为CO32- , 请写出a容器中发生的反应化学方程式: 。
-
(4) 反应后a中有红色固体产生,为探究其组成,提出如下假设:
假设一:只有Cu2O 假设二:只有Cu
假设三:CuO和Cu 假设四:;
其中假设三明显不成立,理由是。
-
(5) 为了对(4)的猜想进行验证,进行如下实验(以下任步均充分反应):
已知:已知:Cu2O
 [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)  [Cu(NH3)4]2+ (蓝色)
[Cu(NH3)4]2+ (蓝色) 
①锥形瓶ii中固体加入浓氨水后,完全溶解得到深蓝色溶液,该过程所发生的离子方程式为 ;
②将容量瓶ii中的溶液稀释20倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为。
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SO2有漂白性 | SO2可使溴水褪色 |
B | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性:S>C |
C | 向铁和稀硝酸反应后的漭液中若滴加KSCN溶液显红色:若滴加酸性高锰酸钾溶液紫红色褪去 | 该溶液中既有Fe3+ , 还有Fe2+ |
D | 浓硫酸有脱水性 | 浓硫酸可用于干燥H2和CO |
 B . 制取乙酸乙酯
B . 制取乙酸乙酯  C . 比较氮、碳、硅元素非金属性
C . 比较氮、碳、硅元素非金属性  D . 检验碘离子
D . 检验碘离子 

-
(1) 装置②中用稀盐酸与CaCO3反应制备CO2 , 在加稀盐酸时,发现CaCO3与稀盐酸不能接触,而稀盐酸又不够了,为使反应能顺利进行,可向长颈漏斗中加入的试剂是_______。A . H2SO4溶液 B . CCl4 C . 苯 D . 稀硝酸
-
(2) 请将图中各装置按顺序连接(填装置接口字母):c接,接,接,接。
-
(3) 装置④的作用是。
-
(4) 检查完装置气密性并装好药品后,点燃酒精灯之前应进行的操作是打开弹簧夹,让CO2充满整个装置,当观察到时再点燃酒精灯。
-
(5) 若反应过程中CO2足量,钠与CO2充分反应后,生成的固体物质可能有多种情况,该同学提出以下猜想:
①生成的固体物质为Na2CO3
②生成的固体物质为Ns2CO3和C的混合物
③生成的固体物质为Ns2CO3和Na2O的混合物
④生成的固体物质为Ns2O和C的混合物
假如反应过程中有下列两种情况:
I. 观察到装置⑤PdCl2溶液中有黑色沉淀,若装置①中固体成分只有一种,且向固体中加入稀盐酸可产生能使澄清石灰水变浑浊的气体,写出该情况下钠与CO2反应的化学方程式。
II. 装置①中钠的质量为0.46g,充分反应后,将装置①中的固体加入足量的稀盐酸中产生224ml(标准状况)CO2气体,溶液中残留固体的质量为。
-
(6) 设计实验方案证明装置①中加入的金属钠部分被氧化。

-
(1) 实验Ⅰ.制取氯酸钾、次氯酸钠和氯水
写出装置A实验室制取Cl2的化学方程式。
-
(2) 制取实验结束后,取出装置B中试管,冷却结晶、过滤、洗涤。该实验操作过程需要的玻璃仪器有胶头滴管、烧杯、、。为提高氯酸钾和次氯酸钠的产率,在实验装置中还需要改进的是。
-
(3) 装置C中反应需要在冰水浴中进行,其原因是。
-
(4) 实验Ⅱ.尾气处理
实验小组利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响)。
①提出合理假设
假设1:只存在SO32-;假设2:既不存在SO32- , 也不存在ClO-;假设3:。
②设计实验方案,进行实验。请完成下列表格,写出相应的实验步骤以及预期现象和结论。
限选实验试剂:3 mol· L-1 H2SO4、1 mol· L-1NaOH溶液、0.01 mol· L-1酸性KMnO4溶液、淀粉KI溶液。
实验步骤
预期现象和结论
步骤1:取少量吸收液分置于A、B试管中
步骤2:向A试管中滴加0.01 mol·L-1酸性KMnO4溶液
若溶液褪色,则假设1成
若溶液不褪色,则假设2或3成立
步骤3:
-
(1) I.已知:NaBr+H2SO4(浓)
 NaHSO4+ HBr CH3CH2OH+HBr
NaHSO4+ HBr CH3CH2OH+HBr  CH3CH2Br+H2O
CH3CH2Br+H2O 溴乙烷的沸点38.4℃,实验室制备溴乙烷(CH3CH2Br)的装置和步骤如下:
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。
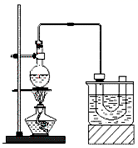
回答下列问题:
为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是。
-
(2) 浓硫酸具有强氧化性,能氧化还原性气体HBr为Br2 , 导致U形管中粗制的溴乙烷呈棕黄色。为了除去粗产品中的杂质Br2 , 可选择下列试剂中的:(填序号)
A.NaOH溶液 B.H2O
C.Na2SO3溶液 D.CCl4
分离时所需的主要玻璃仪器是(填仪器名称)。要进一步制得纯净的溴乙烷,可用水洗,然后加入无水CaCl2 , 再进行(填操作名称)。
-
(3) II.溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
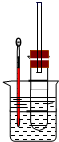
在试管中加入5 mL 1 mol/L NaOH水溶液和5 mL 溴乙烷,将试管如图固定后,加热。
①试管口安装一长导管的作用是。
②鉴定生成物中乙醇的结构,可用的波谱是和。
-
(4) 在试管中加入5 mL NaOH乙醇溶液和5 mL 溴乙烷,将试管如图固定后,加热。
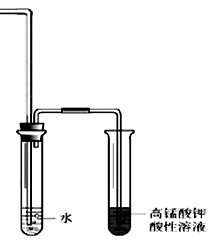
①请写出该反应的化学方程式。
②为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在设计的实验方案中,需要检验的是,检验的装置如图所示,在气体通入酸性高锰酸钾溶液前加一个盛水的试管,其作用是。
-
(1) 84 消毒液使用时除了要按一定比例稀释,对消毒时间也有要求,一般在 10-20 分钟左右。结合有关的化学方程式解释原因,家庭使用 84 消毒液时,可以采取哪些措施缩短消毒时间。
-
(2) 次氯酸钠可以用于去除废水中的铵态氮,配平下列离子方程式。
NH
 +ClO-→N2+Cl-+H2O+H+
+ClO-→N2+Cl-+H2O+H+ -
(3) 84 消毒液的制取和漂粉精的制取原理相同,都是用氯气和碱反应来制取,84 消毒液所用的碱是氢氧化钠溶液,写出该反应的离子方程式。
-
(4) 消毒学专家指出,将 84 消毒液与洁厕灵(主要成分:浓盐酸)一起合并使用,可能会导致使用者的呼吸道伤害。结合有关的化学方程式分析可能的原因。
-
(5) 有同学看到某品牌的 84 消毒液的注意事项有指出:“不得将本品与酸性产品同时使用”。这里酸并没有特指盐酸,该品牌的产品说明是否具备科学性呢?说出你的理由,并设计实验进行验证。
-
(1) 取1mol•L﹣1的Na2SO3溶液置于空气中,测得其pH随时间的变化曲线如图所示:
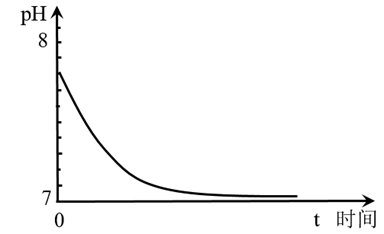
①最初,Na2SO3溶液pH=7.8,解释其原因的离子方程式是。
②t时间段内,造成其pH发生上述变化,用离子方程式解释是。
-
(2) 探究Na2SO3溶液与FeCl3溶液实际反应的情况:
实验ⅰ
装置
操作
现象

向2mL1mol•L﹣1FeCl3溶液中,逐滴滴加1mo•L﹣1Na2SO3溶液2mL
溶液黄色逐渐加深,最终得红褐色溶液(W)
实验ⅱ
装置
操作
现象

取1mL溶液W于试管中,向其滴加过量盐酸,再滴加5滴BaCl2溶液
产生白色沉淀
①实验ⅱ证明,溶液中含有离子;
②对Na2SO3溶液与FeCl3溶液实际反应存在两种认识:
认识Ⅰ.反应中Fe3+完全转化为Fe2+ , W溶液中c(Fe2+)一定很大,反应的离子方程式是。
认识Ⅱ.W溶液中c(Fe2+)应该极小,否则W溶液不会呈红褐色。
-
(3) 资料显示:Fe2+呈淡绿色、FeSO3是墨绿色沉淀、碱式硫酸铁[Fe4(OH)2(SO4)5]溶液为红褐色。
①实验中始终未出现墨绿色沉淀,说明c(Fe2+)极小,其原因用离子方程式解释是。
②实验过程和结果显示,O2、Fe3+、SO
 的氧化性强弱顺序是。
的氧化性强弱顺序是。③若Fe4(OH)2(SO4)5是造成溶液W呈红褐色的原因之一,其形成的化学方程式是。
④用激光笔照射W溶液,发现有丁达尔现象,用离子方程式解释原因是。
选项 | 实验操作及现象 | 实验结论 |
A | 某溶液做焰色试验,若火焰颜色为黄色 | 该溶液中一定不含钾元素 |
B | 向某溶液中逐滴加入氢氧化钠溶液至过量,先无现象后产生白色沉淀,最后白色沉淀部分溶解 | 该溶液中可能含有Al3+ |
C | 向某溶液中滴入氯水无现象,再滴入KSCN溶液后溶液变红 | 该溶液中一定含有Fe2+ |
D | 向某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成 | 该溶液中 一定含有SO |
-
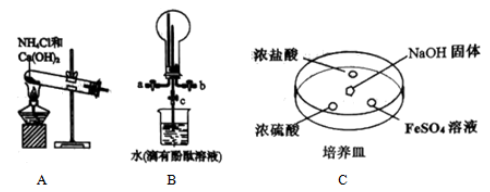
(1) 实验室用装置A制备氨气的化学方程式为。
-
(2) 用装置B收集氨气时,进气口是(选填“a”或“b”)。打开装置B中的活塞c,烧瓶内产生了红色喷泉,则说明氨具有的性质是,。
-
(3) 向C中
 固体上滴几滴浓氨水,迅速盖上玻璃片,浓盐酸液滴附近会出现白烟,发生反应的化学方程式为,检验白烟中阴离子的方法是。
固体上滴几滴浓氨水,迅速盖上玻璃片,浓盐酸液滴附近会出现白烟,发生反应的化学方程式为,检验白烟中阴离子的方法是。 液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应有
液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应有 和。
和。
 水解反应:
水解反应:  (黄色)
(黄色) 
 (红褐色)+3HCl的条件。
(红褐色)+3HCl的条件。 | 实验序号 | 实验操作 | 实验现象 |
| 1 | 将 | 溶液颜色变深 |
| 2 | 向 | 溶液颜色变浅 |
| 3 | 向 | _______ |
| 4 | 向 | 产生红褐色沉淀,同时产生气体 |
下列有关说法正确的是( )
 B . 实验2中
B . 实验2中  水解反应的化学平衡常数变小
C . 实验3得到的现象是溶液颜色变浅
D . 实验4中反应的离子方程式为
水解反应的化学平衡常数变小
C . 实验3得到的现象是溶液颜色变浅
D . 实验4中反应的离子方程式为 
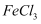 的性质,进行了如下实验(
的性质,进行了如下实验( 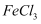 和
和 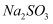 溶液浓度均为
溶液浓度均为 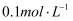 )。
)。
|
实验 |
操作与现象 |
|
① |
在 |
|
② |
在 再滴加 |
|
③ |
在 将上述混合液分成两份,一份滴加 另一份煮沸,产生红褐色沉淀。 |
依据上述实验现象,结论不合理的是( )
 水解反应
B . 实验②说明
水解反应
B . 实验②说明  既发生了水解反应,又发生了还原反应
C . 实验③说明
既发生了水解反应,又发生了还原反应
C . 实验③说明  发生了水解反应,但没有发生还原反应
D . 整个实验说明
发生了水解反应,但没有发生还原反应
D . 整个实验说明 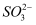 对
对  的水解反应无影响,但对还原反应有影响
的水解反应无影响,但对还原反应有影响
-
(1) 实验Ⅰ:用下图所示装置测定纯净的光卤石中结晶水的含量。

装置A的作用是。装置B中的试剂是。装置D的作用是。
-
(2) 实验步骤包括:
①点燃装置C处的酒精灯
②打开装置A处的分液漏斗的活塞
③组装仪器,并检查装置的气密性
④装入药品
⑤关闭装置A处的分液漏斗的活塞
⑥熄灭装置C处的酒精灯
上述实验步骤的先后顺序为(填序号)。
-
(3) 写出装置C中硬质玻璃管内发生反应的化学方程式:(光卤石用“KCl·MgCl2·nH2O”表示)。
-
(4) 若装置C中硬质玻璃管的质量为a g,实验前称量得硬质玻璃管和样品的总质量为b g,充分反应并冷却后,称量得硬质玻璃管和剩余固体的总质量为c g。则KCl·MgCl2·nH2O 中n= (用含a、b、c的代数式表示)。
-
(5) 实验Ⅱ:测定纯净的光卤石中Mg2+的质量分数。
取wg纯净的光卤石溶于适当过量的稀硝酸中,再用水稀释,配制成250 mL溶液。取25.00 mL所配制的溶液于锥形瓶中,滴几滴K2CrO4溶液(作指示剂),用c mol·L−1AgNO3标准溶液滴定至终点,消耗AgNO3标准溶液V mL。
纯净的光卤石中所含Mg2+的质量分数为%(用含w、c、V的代数式表示)。
-
(6) 若滴定开始时仰视读数,滴定终点时俯视读数,则测得的结果会(填“偏高”“偏低”或“无影响”)。

-
(1) 仪器a的名称为。
-
(2) 装置甲中发生反应的化学方程式为。
-
(3) 装置乙中饱和食盐水的作用是。
-
(4) 装置丁中收集氯气的方法是,在装满氯气的集气瓶中放入红色鲜花,观察到鲜花褪色,原因是。
-
(5) 装置戊中发生反应的离子方程式为。
-
(6) 充分反应后,将氯离子传感器插入广口瓶丙的溶液中,与数据采集器,计算机连接,用强光照射瓶中溶液,采集数据所得图像如图所示。

①A点溶液发生分解反应的离子方程式为。
②A点溶液中氯元素的存在形式有
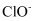 和。
和。

 固体
固体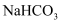 固体
固体 水中滴加2滴
水中滴加2滴  溶液中滴加2滴
溶液中滴加2滴 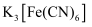 溶液,产生蓝色沉淀。
溶液,产生蓝色沉淀。 溶液中滴加2滴
溶液中滴加2滴 


