粗盐提纯 知识点题库
 ,而又不引入新的杂质离子,应依次加入( )
,而又不引入新的杂质离子,应依次加入( )
①加入稍过量的Na2CO3溶液;
②加入稍过量的NaOH溶液;
③加入稍过量的BaCl2溶液;
④滴入稀盐酸至无气泡产生;
⑤过滤.
-
(1) 精制过程中发生反应的离子方程式为.
-
(2) 如果粗盐中SO42﹣含量较高,必须添加钡试剂除去SO42﹣ , 该钡试剂可以是 (填字母代号).A . Ba(OH)2 B . Ba(NO3)2 C . BaCl2
-
(3) 为有效除去CaCl2、MgCl2以及SO42﹣ , 加入试剂的合理顺序为 (填字母代号).A . 先加过量NaOH,后加过量Na2CO3 , 再加过量钡试剂,过滤后加入稍过量的稀盐酸 B . 先加过量NaOH,后加过量BaCl2 , 再加过量Na2CO3 , 过滤后加入稍过量的稀盐酸 C . 先加过量NaOH,后加过量BaCl2 , 再加过量Na2CO3 , 过滤后加入稍过量的稀硝酸.
①加适量盐酸; ②加过量Na2CO3溶液; ③过滤;
④加过量NaOH溶液; ⑤加过量BaCl2溶液.
-
(1) 以上正确的操作顺序为.
-
(2) 步骤⑤判断BaCl2溶液过量的实验操作方法是.
-
(3) 步骤③实验中所用的玻璃仪器有烧杯、、.
-
(4) 其中,在步骤①中涉及的离子反应方程式有、.
-
(5) 除杂操作完成后,得到NaCl固体操作方法为.
-
(6) m g粗盐提纯后得到n g纯净的NaCl固体,则m与n的大小关系为 .A . m>n B . m<n C . m=n D . 无法确定.
 B .
B . 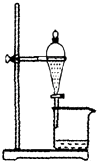 C .
C . 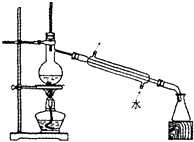 D .
D . 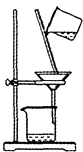
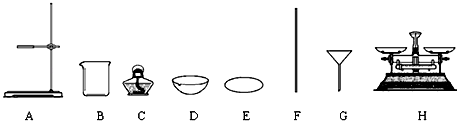
-
(1) D的名称是;
-
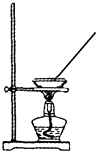
(2) 提纯的步骤是:溶解、过滤、;
-
(3) “过滤”操作的要点可概括为“一贴、二低、三靠”,其中“二低”的含义是;
-
(4) 该实验中多次利用仪器B(填名称)和仪器(填字母序号),且该仪器使用了次.
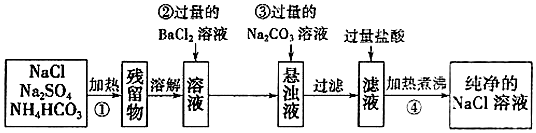
-
(1) 操作①中发生反应的化学方程式是.(已知NH4HCO3受热后没有固体剩余,产生的气体中有一种能使红色石蕊试纸变蓝)
-
(2) 操作②中BaCl2溶液能否改用硝酸钡溶液(填“能”或“不能”).如果能,下一空不需要回答;如果不能,请说明理由:.
-
(3) 操作③的目的是;请你用实验方法确认操作③中碳酸钙碳酸钙已过量:.
-
(4) 操作④的目的是.
 滤液
滤液  氯化钠晶体
氯化钠晶体
-
(1) 从稀盐酸、Na2CO3、Ba(OH)2、K2CO3、Ba(NO3)2溶液中选择试剂:A、B、C.(填化学式)
-
(2) 操作1和操作2的名称分别为、.
-
(3) 写出加B时发生的化学反应方程式.
-
(4) 控制加适量C的方法是.
称取粗盐 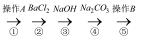 滤液
滤液  精盐
精盐
-
(1) 第①步中,操作A是,第⑤步中,操作B是.
-
(2) 第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2).
-
(3) 若先加入盐酸再过滤,将对实验结果产生影响,其原因是.
-
(4) 判断Na2CO3已过量的方法是.
 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):称取粗盐  滤液
滤液  精盐
精盐
-
(1) 判断BaCl2已过量的方法是.
-
(2) 第④步中,相关的化学方程式是.
-
(3) 配制NaCl溶液时,若出现下列操作,其结果偏高还是偏低?
A.称量时NaCl已潮解 B.天平的砝码已锈蚀
C.定容摇匀时,液面下降又加水 D.定容时俯视刻度线.
-
(1) 在仪器①漏斗、②容量瓶、③蒸馏烧瓶、④分液漏斗、⑤烧杯、⑥蒸发皿 中,可用于粗盐提纯实验的有;可用于分离两种沸点接近且互不相溶的液态混合物实验的有。
-
(2) 有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验。
①将该粉末溶于水得无色溶液和白色沉淀。
②在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体。
③取滤液做焰色反应,可证明滤液中含Na+ , 不含K+。
由上述现象推断:
该混合物中一定含有;一定不含有,可能含有。
-
(3) 正常人的血液中葡萄糖(简称血糖,分子式为C6H12O6)的浓度在3.61-6.11mmol/L之间,今测得某病人1mL血液中含葡萄糖0.60mg,相当于mmol/L,血糖属正常、偏高还是偏低?。
-
(1) Ⅰ用CCl4萃取碘水中的碘,下图的分液漏斗中,下层液体呈色;打开分液漏斗活塞,却未见液体流下,原因可能是。

-
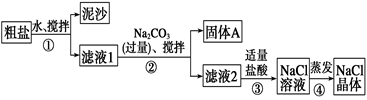
(2) Ⅱ 某同学用某种粗盐进行提纯实验,步骤见下图。
请回答下列问题:
步骤①和②的操作名称是。
-
(3) 步骤③判断加入盐酸“适量”的方法是;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了,当蒸发皿中有较多量固体出现时,应停止加热,用余热使水分蒸干。
-
(4) 猜想和验证:
猜想
验证的方法
现象
结论
猜想Ⅰ:固体A中含CaCO3、MgCO3
取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口
猜想Ⅰ成立
猜想Ⅱ:固体A中含BaCO3
取少量固体A于试管中,先滴入,再滴入Na2SO4溶液
有气泡放出,无白色沉淀
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4
取少量NaCl晶体溶于试管中的蒸馏水,
猜想Ⅲ成立
 、
、  ,
,  及少量泥沙,得到纯净的
及少量泥沙,得到纯净的  ,可将粗盐溶于水,下列操作顺序正确的是( )
,可将粗盐溶于水,下列操作顺序正确的是( ) ①过滤 ②加入过量的  溶液 ③加入过量的盐酸 ④加入过量的
溶液 ③加入过量的盐酸 ④加入过量的  溶液 ⑤加入过量的
溶液 ⑤加入过量的  溶液 ⑥加热蒸发
溶液 ⑥加热蒸发
 、
、  、
、  等杂质离子)精制成NaCl溶液的部分流程。下列说法错误的是( )
等杂质离子)精制成NaCl溶液的部分流程。下列说法错误的是( ) ![]()
 溶液
B . ②中加入过量
溶液
B . ②中加入过量  溶液后,只有
溶液后,只有 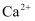 被除去
C . ③中加入过量NaOH溶液后过滤,还需加适量稀盐酸
D . 杂质离子的去除顺序还可以是③①②
被除去
C . ③中加入过量NaOH溶液后过滤,还需加适量稀盐酸
D . 杂质离子的去除顺序还可以是③①②
 , 设计工艺流程如下图所示:
, 设计工艺流程如下图所示:
下列说法不正确的是( )
①Na2O2投入到紫色石蕊试液中溶液先变蓝,后褪色;
②Na2O 和Na2O2投入到水中都能生成NaOH;
③质量相等的NaHCO3与Na2CO3分别与相同浓度盐酸完全反应时,产生CO2的物质的量相等;
④为了除去粗盐中的Ca2+、Mg2+、SO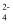 及泥沙,可将粗盐溶于水;然后按下列顺序进行操作∶加过量BaCl2溶液一加过量的NaOH溶液-过量 Na2CO3溶液-过滤一加过量盐酸-加热煮沸
及泥沙,可将粗盐溶于水;然后按下列顺序进行操作∶加过量BaCl2溶液一加过量的NaOH溶液-过量 Na2CO3溶液-过滤一加过量盐酸-加热煮沸
⑤区别NaHCO3与 Na2CO3溶液,可用Ca(OH)2溶液;
⑥NaHCO3固体可以做干粉灭火剂,金属钠起火可以用它来灭火;
⑦NaHCO3粉末中混有Na2CO3可配制成溶液通入过量的CO2 , 再低温结晶得到提纯。



