粗盐提纯 知识点题库
-
(1) 下列操作正确的顺序是:
①称取粗盐溶解②加过量Na2CO3③加过量NaOH④加过量BaCl2⑤过滤⑥蒸发、结晶、烘干得到 精盐⑦往滤液中加入适量的盐酸
-
(2) 判断BaCl2已过量的方法是
-
(3) 加过量Na2CO3时相关的离子方程式是
-
(4) 若先用盐酸调PH再过滤,将对实验结果产生影响,其原因是
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水.
-
(1) 过程Ⅰ除去的离子是
-
(2) 过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
CaSO4
Mg2(OH)2CO3
CaCO3
BaSO4
BaCO3
2.6×10﹣2
2.5×10﹣4
7.8×10﹣4
2.4×10﹣4
1.7×10﹣3
①检测Fe3+是否除尽的方法是 .
②过程Ⅰ选用BaCl2而不选用CaCl2 , 运用表中数据解释原因 .
③除去Mg2+的离子方程式是 .
④检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是
-
(3)
第二次精制要除去微量的I﹣、IO3﹣、NH4+、Ca2+、Mg2+ , 流程示意如图:
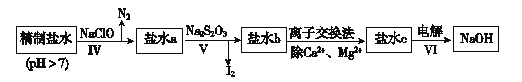
①过程Ⅳ除去的离子是 .
②盐水b中含有SO42﹣ . Na2S2O3将IO3﹣还原为I2的离子方程式是 .
③过程Ⅵ中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:
-
(1) 取一定量的粗盐置于烧杯中加水溶解,所加的水量应为: . (填选项)A . 多加水配成较稀的溶液 B . 加入适量的水至能溶解的固体溶解即止
-
(2) 将(1)中配制的粗盐悬浊液过滤后取滤液加入过量的除杂试剂,如果除杂试剂可从下列六种溶液中选择 ①Na2CO3溶液 ②KOH溶液 ③AgNO3溶液 ④NaOH溶液 ⑤NaHCO3溶液 ⑥BaCl2溶液,则正确的试剂和加入的顺序应为.(填选项,多选、少选、错选都不得分)
A.①②③B.②⑥⑤C.④⑥①D.①④⑥E.⑥①④F.⑥②⑤
将所得的悬浊液经过滤后取滤液加入足量的盐酸,充分反应后对混合溶液进行蒸发、过滤、洗涤、干燥操作,得到纯净的NaCl固体,请描述在蒸发操作过程中玻璃棒的作用是.
-
(3) 利用(2)中所得的NaCl固体继续配制所需溶液.在托盘天平上称量 g NaCl固体.配制过程中需要使用的玻璃仪器有:烧杯、玻璃棒、和.
-
(4) 配制结束后同学们对实验中出现的某些错误操作,对最终配制的溶液浓度的影响进行了分析,则下列错误操作会导致最终配制溶液中NaCl的浓度相比0.4mol/L的偏差是:(填“偏大”、“偏小”、“无影响”)
①在上述(2)步中没有使用盐酸处理滤液,结果会,
②定容时俯视凹液面,结果会
③上下颠倒摇匀后液面低于刻度线,未及时加水至刻度线,结果会
-
(1) 从草木灰中提取钾盐的实验操作顺序如下:①称量样品,②溶解沉降,③,④,⑤冷却结晶.
-
(2) 用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示 (填选项的标号).A . 左盘重,样品轻 B . 左盘轻,砝码重 C . 右盘重,砝码轻 D . 右盘轻,样品重
-
(3) 在进行②、③、④操作时,都要用到玻璃棒,其作用与目的分别是:
②;③;④.
①过滤②加过量Na2CO3溶液③加过量NaOH溶液④加过量BaCl2溶液⑤加适量HCl,正确的顺序是( )
①过滤
②加过量的NaOH
③加适量盐酸
④加过量Na2CO3溶液
⑤加过量BaCl2溶液
其中正确的操作顺序是( )
 请回答:
请回答:
-
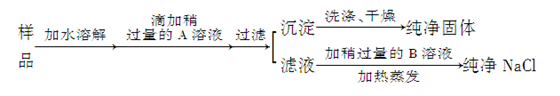
(1) 加入的A是,检验A已过量的方法是。
-
(2) 加入的B是,加入稍过量B的目的是。
-
(3) 为检验沉淀是否洗净,最好在最后几滴洗出液中加入溶液。
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量 Na2CO3溶液 ⑤加过量 BaCl2溶液

-
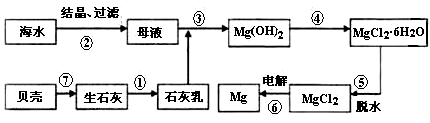
(1) I.上述过程中没有涉及到的四种基本反应类型是;
a.化合反应 b.分解反应 c.置换反应 d.复分解反应
-
(2) 步骤 1 中分离操作的名称是;
-
(3) 粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:a.盐酸;
B.BaCl2溶液;
C.NaOH 溶液;
D.Na2CO3 溶液。加入试剂的顺序是;
-
(4) II.实验室利用精盐配制 240mL 2.0mol/LNaCl 溶液。
除烧杯和玻璃棒外,还需要的玻璃仪器有;
-
(5) 用托盘天平称取固体 NaClg;
-
(6) 配制时,按以下几个步骤进行:①计算 ②称量 ③溶解 ④冷却 ⑤转移 ⑥定容 ⑦ 摇匀 ⑧装瓶。操作中还缺少一个重要步骤是;
-
(7) 下列不符合题意操作可使所配制氯化钠溶液浓度偏低的是。
a.容量瓶洗净后残留了部分的水
b.转移时溶液溅到容量瓶外面
c.定容时俯视容量瓶的刻度线
d.摇匀后见液面下降,再加水至刻度线
e.称量固体的砝码已生锈
下列说法错误的是( )
 等杂质离子,实验室提纯NaCl的流程如图:
等杂质离子,实验室提纯NaCl的流程如图: 
下列说法错误的是( )
 等杂质)为原料制备。实验室提纯NaCl的流程如图:
等杂质)为原料制备。实验室提纯NaCl的流程如图: 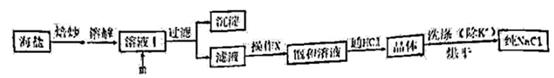
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳
-
(1) 欲除去溶液I中的Ca2+、Mg2+、Fe3+、
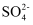 ,在提供的试剂中,选出m所代表的试剂,按滴加顺序依次为、NaOH、(只填化学式);洗涤除去NaCl晶体表面附带的少量KCl,在提供的试剂中,选用的试剂为。
,在提供的试剂中,选出m所代表的试剂,按滴加顺序依次为、NaOH、(只填化学式);洗涤除去NaCl晶体表面附带的少量KCl,在提供的试剂中,选用的试剂为。
-
(2) 操作X为用提纯的NaCl配制500mL 4.00mol/L NaCl溶液,所用的玻璃仪器除烧杯、玻璃棒外还有(填仪器名称)
-
(3) 用如图所示装置,以焙炒后的海盐为原料制备HCl气体,并通入NaCl饱和溶液中使NaCl结晶析出。
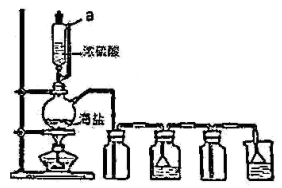
①用浓硫酸和海盐混合加热制取氯化氢利用了浓硫酸的性质是(填编号),相比分液漏斗,选用仪器a的优点是。
a.高沸点 b.强酸性 c.强氧化性
②对比实验发现,将烧瓶中的海盐磨细可加快NaCl晶体的析出,其原因是。
-
(4) 设计实验测定NaCl产品中SO
 的含量,填写表格。
的含量,填写表格。 操作
目的/结论
①
称取样品
 ,加水溶解,加盐酸调至弱酸性,滴加过量c1mol/LBaCl2溶液V1mL
,加水溶解,加盐酸调至弱酸性,滴加过量c1mol/LBaCl2溶液V1mL目的:。
②
过滤洗涤,干燥后称得沉淀为m2g
结论:样品中SO
 的质量分数为。(列算式)
的质量分数为。(列算式)
已知:NH4HCO3 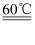 NH3↑+H2O+CO2↑。
NH3↑+H2O+CO2↑。

-
(1) 操作①为 ;操作③为 。
-
(2) 试剂 1、试剂 2 分别为 、 (填化学式);试剂均需过量的目的是 。
-
(3) 经过操作②所得的滤渣是(填化学式)。
-
(4) 调节溶液的 pH 时,通常使 pH 小于 7,其目的是(用化学方程式表示)。



