化学键 知识点题库
-
(1) 它们的元素符号分别为:A;B;C;
-
(2) BC2是由键组成的(填“极性”或“非极性”)分子.
-
(3) 画出C原子的核外电子排布图.
-
(4) A2C和BC2的空间构形分别是和.
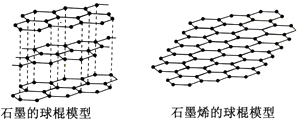
Ⅰ A | Ⅱ A | Ⅲ A | Ⅳ A | Ⅴ A | Ⅵ A | Ⅶ A | 0 | |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
-
(1) 其中原子半径最小的是元素,没有正化合价的是元素。
-
(2) 其中非金属元素有 种,非金属性最强的是元素。
-
(3) 其中气态氢化物溶于水呈碱性的是元素,其气态氢化物的化学式是。
-
(4) 其中最高价氧化物对应水化物碱性最强的是元素, 其最高价氧化物对应水化物化学式是其最高价氧化物对应化物含有的化学键类型是。
-
(5) ⑩ 号元素最高正价含氧酸只具有键
①分子晶体中都存在共价键; ②在晶体中只要有阳离子就一定有阴离子;
③金刚石、NaF、NaCl、H2O、H2S晶体的熔点依次降低;
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键;
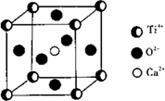
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti3+和12个O2-相邻;
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合;
⑦晶体中分子间作用力越大,分子越稳定;
⑧氯化钠熔化是离子键被破坏
下列说法不正确的是( )
-
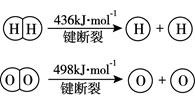
(1) 化学反应中能量变化的主要原因是旧的化学键断裂会能量;新的化学键形成会能量。(填“放出”或“吸收”)
-
(2) 用铝热法可冶炼铁,其反应为:Fe2O3+2Al
 2Fe+Al2O3 , 属于放热反应,反应物的总能量(填“>”、“=”或“<”)生成物的总能量。在该反应中,若消耗了1molAl,则理论上可炼制Fe的物质的量为mol。
2Fe+Al2O3 , 属于放热反应,反应物的总能量(填“>”、“=”或“<”)生成物的总能量。在该反应中,若消耗了1molAl,则理论上可炼制Fe的物质的量为mol。
-
(3) 为探究反应过程中的能量变化,某小组同学用如图装置进行实验。
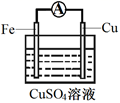
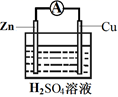
装置Ⅰ
装置Ⅱ
①装置Ⅰ中,Fe与CuSO4溶液反应的离子方程式是。
②装置Ⅱ中,正极的电极反应式为。
③关于装置Ⅱ,下列叙述正确的是(填字母)。
a.H+在Cu表面被还原,产生气泡
b.电流从Zn片经导线流向Cu片
c.电子从Zn片经导线流向Cu片
d.Zn和Cu的都是电极材料,也都参与电极反应
-
(4) 某兴趣小组将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是_____。
 A . 从t1→t2的原因是镁与酸的反应是放热反应,体系温度升高 B . 从t1→t2的原因水蒸发,致使酸的浓度升高 C . 从t2→t3的原因是随着反应的进行镁条的质量下降 D . 从t2→t3的原因是随着反应的进行,H+的浓度逐渐下降
A . 从t1→t2的原因是镁与酸的反应是放热反应,体系温度升高 B . 从t1→t2的原因水蒸发,致使酸的浓度升高 C . 从t2→t3的原因是随着反应的进行镁条的质量下降 D . 从t2→t3的原因是随着反应的进行,H+的浓度逐渐下降
 ,
,  是制备全氮类物质N10(其中含有
是制备全氮类物质N10(其中含有  和
和  两种离子)的重要中间体。下列说法错误的是( )
两种离子)的重要中间体。下列说法错误的是( )
 中含有35个质子
C . 每个
中含有35个质子
C . 每个  中含有35个电子
D . N10结构中含非极性共价键和离子键
中含有35个电子
D . N10结构中含非极性共价键和离子键

 NO2+H2O
B . 反应历程中还可能形成HONO···H2O
C . 该反应历程中最大能垒(活化能)为201.1kJ·mol-1
D .
NO2+H2O
B . 反应历程中还可能形成HONO···H2O
C . 该反应历程中最大能垒(活化能)为201.1kJ·mol-1
D . -
(1) Ⅰ.主族元素能形成多种化合物,它们是探测器、激光器、微波器的重要材料。
氧原子价电子层上的电子可以进行重排以便提供一个空轨道与氮原子形成配位键,该氧原子重排后的价电子排布图为,电子重排后的氧原子能量有所升高,原因是不符合(填“泡利原理”或“洪特规则”)。
-
(2) 自然界中不存在单质硼,硼的氢化物也很少,主要存在的是硼的含氧化合物,根据下表数据分析其原因是。
化学键
B-H
B-O
B-B
键能(kJ·mol-1)
389
561
293
-
(3) NH3与BF3气体相遇发生反应生成F3B-NH3晶体
①F3B-NH3晶体中,B原子的杂化轨道类型为。
②F3B-NH3晶体中不存在的作用力有。
a.σ键 b.π键 c.离子键 d.配位键 e.范德华力
-
(4) 已知:
物质
AsF3
AsCl3
BiF3
沸点/℃
62.8
130.2
900.0
解释表中物质之间沸点差异的原因。
-
(5) Ⅱ.储氢合金能有效解决氢气的储存和运输,对大规模使用氢能具有重要意义。
某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示。M是(填元素符号),判断理由是。
I1/kJ·mol-1
I2/kJ·mol-1
I3/kJ·mol-1
I4/kJ·mol-1
I5/kJ·mol-1
738
1451
7733
10540
13630
-
(6) 过渡金属Q与镧(La)形成的合金也是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1;该合金的晶胞结构和z轴方向的投影图如图所示。

若阿伏加德罗常数的值为NA , 则该合金的密度ρ=g·cm-3(用含a、c、NA的代数式表示,列出计算式即可)。
-
(1) 基态Cr原子的价电子排布式为;Cr成为阳离子时首先失去轨道的电子。
-
(2) 铬与钾均位于第四周期,铬的熔点和沸点均比钾的高,这是因为。
-
(3) 甘氨酸铬(结构如图)是一种配合物,其配位原子是。

-
(4) 反应:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+16K2SO4+55H2O
①KSCN的四种组成元素中第一电离能最大的是(填元素符号);KSCN中阴离子的空间构型为形,中心原子的杂化方式是。
②分子中的大
 键可用符号
键可用符号 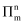 表示,其中m代表参与形成大
表示,其中m代表参与形成大  键的原子数,n代表参与形成大
键的原子数,n代表参与形成大  键的电子数(如苯分子中的大
键的电子数(如苯分子中的大  键可表示为
键可表示为  ),则NO2的大
),则NO2的大  键可表示为。
键可表示为。 -
(5) 立方CrO2晶体的结构如图所示,晶胞参数为apm。

①设NA为阿伏加德罗常数的值,则CrO2的密度为(列出计算式)g·cm-3。
②1、2号原子的坐标依次为(0,0,0)、(
 ,0,
,0,  ),则原子坐标为(
),则原子坐标为( 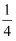 ,
, 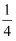 ,
, 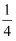 )和(
)和(  ,
,  ,
,  )间的距离为pm。
)间的距离为pm。
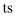 表示过渡态)
表示过渡态)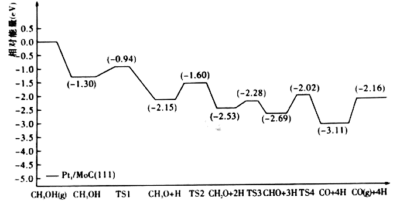
下列说法正确的是( )
 的脱氢反应是分步进行的
B . 甲醇脱氢反应历程的最大能垒(活化能)是
的脱氢反应是分步进行的
B . 甲醇脱氢反应历程的最大能垒(活化能)是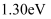 C . 甲醇脱氢反应中断裂了极性键和非极性键
D . 该催化剂的研发为醇类重整产氢的工业应用提供了新思路
C . 甲醇脱氢反应中断裂了极性键和非极性键
D . 该催化剂的研发为醇类重整产氢的工业应用提供了新思路



