化学键 知识点题库
关于化学键的下列叙述中正确的是( )
A . 化学键存在于相邻原子之间,是一种强相互引力作用
B . 化学键可存在于不同种元素的原子之间,也可存在于同种元素的原子之间
C . 化学键中原子间强烈作用的实质是万有引力作用
D . 单质中一定存在化学键作用
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n。已知,最简单的氢铝化合物的分子式为Al2H6 , 它的熔点为150℃,燃烧时放出大量的热量。Al2H6球棍模型如下图。下列说法肯定错误的是( )
A . Al2H6在固态时所形成的晶体是分子晶体
B . 氢铝化合物可能成为未来的储氢材料和火箭燃料
C . Al2H6在空气中完全燃烧,产物为氧化铝和水
D . Al2H6中含有离子键和极性共价键
第28届国际地质大会提供的资料显示,在海底蕴藏着大量的天然气水合物,俗称“可燃冰”(CH4·nH2O)。其蕴藏量是地球上煤和石油的几百倍,因而是一种等待开发的巨大能源物质。下列有关可燃冰的预测中错误的是( )。
A . 高压、低温有助于可燃冰的形成
B . 可燃冰的主要成分是甲烷
C . 可燃冰的微粒间可能存在着离子键
D . 构成可燃冰的原子间存在着极性共价键
下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A . NH4Cl→NH3↑+HCl↑
B . NH3+CO2+H2O→NH4HCO3
C . 2NaOH+Cl2→NaCl+NaClO+H2O
D . 2Na2O2+2CO2→2Na2CO3+O2
意大利科学家使用普通氧分子和带正电的氧离子作用,制出了新型的氧分子O4 , 它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子.
![]()
-
(1) 下列有关O4的说法正确的是:
A.O4分子内存在极性共价键
B.合成O4的反应可看作核聚变反应,不属于化学变化
C.O4与O3、O2都是氧的同素异形体
D.O4将来可用作更强有力的火箭推进的氧化剂
-
(2) 制备含O2﹣、O22﹣甚至O2+的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的:上述变化中,(填序号)相当于氧分子被氧化;(填序号)相当于氧分子被还原.
-
(3) 写出O22﹣的电子式:
-
(4) O2+、O2﹣中的电子数分别为:;.
下列关于乙烯(CH2=CH2)的说法不正确的( )
A . 乙烯分子中2个碳原子都是sp2杂化
B . 乙烯分子存在非极性键
C . 乙烯分子中4个H原子在同一平面上
D . 乙烯分子有6个σ键
下列说法正确的是( )
A . 含有共价键的化合物一定是共价化合物
B . 在共价化合物中一定含有共价键
C . 离子化合物中只含有离子键
D . 化学键断裂的变化一定是化学变化
下列各组物质中,化学键类型完全相同的是( )
A . HI和NaI
B . H2S和CO2
C . H2O2和CCl4
D . Na2O2和NaBr
下列化合物中所有化学键都是共价键的是( )
A . Na2O2
B . NaOH
C . BaCl2
D . H2SO4
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。气态时,已知断裂1mol N—N键吸收193kJ热量,断裂1mol N≡N键吸收941kJ热量,则( )
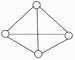
A . N4与N2互称为同位素
B . 1mol N4气体转化为N2时要吸收748kJ能量
C . N4是N2的同系物
D . 1mol N4气体转化为N2时要放出724kJ能量
氮族元素在化学领域具有重要的地位。请回答下列问题:
-
(1) 基态氮原子的价电子轨道表示式为;第二周期的元素中,第一电离能介于B和N之间的元素有种。
-
(2) 雌黄的分子式为As2S3 , 其分子结构如图所示:
 As原子的杂化类型为。
As原子的杂化类型为。
-
(3) ①向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加入一定量的乙醇,析出[Cu(NH3)4]SO4·H2O固体。SO42-的空间构型为;[Cu(NH3)4]SO4·H2O固体中含有的化学键有(填标号)。
A.离子键 B.共价键 C.氢键 D.金属键 E.配位键
若要确定[Cu(NH3)4]SO4·H2O是晶体还是非晶体,最科学的方法是进行实验。
②已知NF3与NH3分子的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,原因是。
-
(4) 大π键可用
 表示,其中n、m分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为
表示,其中n、m分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为  。N2O分子中的大π键表示为。
。N2O分子中的大π键表示为。
-
(5) 立方氮化硼晶胞如图,其密度为ρg/cm3 , 氮化硼的摩尔质量为Mg/mol,阿伏加德罗常数的值为NA , 硼原子的半径为r cm,则硼原子的空间占有率为(用含有ρ、M、NA、r的代数式表示)。

短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,该单质与沸水缓慢反应,且该单质可制造照明弹;f为固体单质。下列有关说法正确的是( )

A . 简单离子的半径:Y>Z>X
B . 元素的非金属性:W>X
C . 最高价氧化物对应水化物的碱性:Y>Z
D . X、Y两种元素组成的化合物只含离子键
A、B、C、D四种常见元素的结构信息如下表。试根据信息回答有关问题。
|
元素 |
A |
B |
C |
D |
|
性质结构信息 |
最常见氢化物X为三角锥分子且能与 HCl发生化合反应生成盐 |
原子的 M 层上电子数比L层电子数少2个 |
ds区元素,N 层上有一个电子 |
原子的s电子数是p电子数的2倍 |
-
(1) 写出基态B原子的电子排布式:。
-
(2) 向CSO4的溶液中逐滴加入过量X的水溶液,可生成的配合物的化学式为 ,该物质中不存在的作用类型为(填字母)。
a.离子键 b.配位键 c.极性键 d.氢键
-
(3) 下列几种氢化物分子:
① AH3 ②D2H2③H2B ④DH4
中心原子采用sp3杂化形成化学键的是 (填序号);在②的分子中有 个σ键,该分子中电子运动状态共有 种。
下列物质中,只含有离子键的是( )
A . HCl
B . CaCl2
C . NH4Cl
D . NaOH
丁二酮肟可用于镍的检验和测定,其结构式如图:

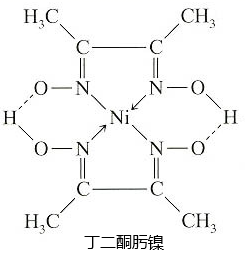
-
(1) Ni元素基态原子价层电子排布图为,核外电子占据最高能层的符号为。
-
(2) N原子中能量最高的是电子(填能级符号),其电子云在空间有个伸展方向。
-
(3) 丁二酮肟镍分子内含有的作用力有(填字母)。
a.配位键 b.离子键 c.氢键 d.范德华力
-
(4) H和N可以形成多种化合物。
①已知联氨(N2H4)的熔沸点与水接近,其原因是;
②计算表明:N4H
 的一种结构如图所示,氢原子只有一种化学环境,氮原子有两种环境,其中的大π键可表示为(已知苯的大π键可以表示为
的一种结构如图所示,氢原子只有一种化学环境,氮原子有两种环境,其中的大π键可表示为(已知苯的大π键可以表示为 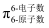 )。
)。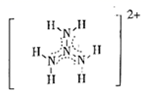
-
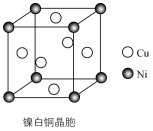
(5) Ni(CO)4常用于制备纯镍,写出与配体互为等电子体的阴离子(任写一种)。某镍白铜的晶胞如图所示,其化学式为。元素铜与镍的第二电离能分别为:ICu=1958kJ·mol-1、INi=1753kJ·mol-1 , ICu>INi的原因是。
下图为N2分子在催化剂的作用下发生的一系列转化示意图:
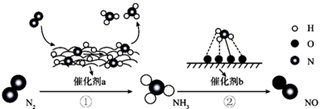
下列叙述错误的是( )
A . 反应①和反应②均属于氮的固定
B . 在反应①和反应②中,均有极性共价键形成
C . 在催化剂a、b的作用下,提高了反应速率
D . 在催化剂b作用下,氮原子发生了氧化反应
下列化合物中的化学键中,只有共价键的是( )
A . NH4Cl
B . HCl
C . NaCl
D . Na2SO4
下列说法正确的是( )
A . Na+的离子半径比O2-大
B . F的非金属性比S强
C . Be(OH)2的碱性比Mg(OH)2强
D . NH4Cl不含离子键,只含共价键
下列说法错误的是( )
A . 氢键、离子键和共价键都属于化学键
B . 化学家门捷列夫编制了第一张元素周期表
C . 药剂师和营养师必须具备化学相关专业知识
D . 石灰石是制造玻璃和水泥的主要原料之一
下列物质属于离子化合物且含有共价键的是( )
A . 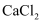 B .
B .  C .
C .  D .
D . 
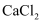 B .
B .  C .
C .  D .
D . 
最近更新



